|
|
|
|
Les
batteries les plus employées dans les voitures sont de technologie
Plomb Acide 12V.
Elles sont composées de 6 accumulateurs élémentaires (schéma
ci-dessous) montés en série.
L’électrode A en plomb est recouverte d’oxyde de plomb.
L’électrolyte est une solution concentrée d’acide sulfurique (2 H+,
SO42-) en milieu aqueux.
L’électrode B est en plomb.
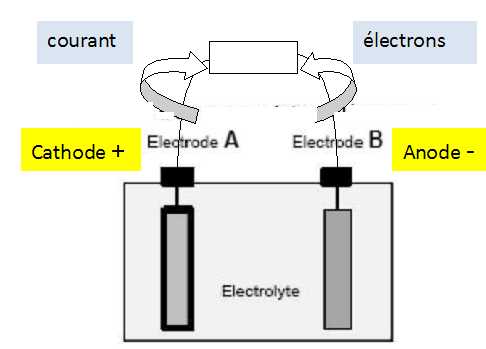
Etude d’un accumulateur élémentaire lors de la décharge :
Ecrire la réaction de la transformation du plomb Pb de l’électrode B en ions Pb2+.
Oxydation du plomb à l'anode négative B : Pb(s) = Pb2+ +2e-.
Equilibrer la réaction de l’électrode A (demi pile PbO2/ Pb2+ en milieu acide).
Réduction de l'oxyde de plomb à la cathode positive A :
PbO2(s) + 2e- + 4H+ = Pb2+ + 2H2O.
Quelles sont le ou les espèces chimiques portant majoritairement le courant électrique dans l’électrolyte de la batterie.
Les ions( H+, SO42-, Pb2+ ) assurent le passage du courant dans l'électrolyte.
Placer sur le schéma du document réponse les sens de déplacement des électrons et du courant ainsi que l’anode et la cathode.
• Etude d’un accumulateur élémentaire lors de la charge :
Le
générateur fonctionne comme une pompe à électrons. Il va forcer les
électrons à circuler dans l’autre sens. L’accumulateur devient alors un
récepteur.
Ecrire la réaction des ions Pb2+ qui capte les électrons pour reformer du plomb.
Réduction des ions Pb2+ à la cathode négative B : Pb2+ + 2e- = Pb(s).
Equilibrer la réaction de la reconstitution de l’oxyde du plomb PbO2. Repérer la cathode et l’anode de la batterie.
Oxydation de Pb2+ à l'anode A positive :
Pb2+ + 2H2O = PbO2(s) + 2e- + 4H+.
|
.
|
Etude des caractéristiques d’une batterie.
Batterie : 12 V 40 Ah ; plomb acide ; poids 14,6 kg ;
On charge cette batterie pendant 6 h avec un courant d’intensité constante égale à 7,8 A
Déterminer la quantité d’électricité Q (Q en Ah puis en coulomb C).
Q = It = 7,8 *6 =46,8 ~47 Ah ou 46,8*3600 =1,685 105 ~1,7 105 C.
La batterie étant initialement complètement déchargée, elle atteint sa charge maximale (sa capacité nominale de 40 Ah).
Calculer la capacité d’électricité Qp perdue au cours de cette charge totale.
46,8-40 = 6,8 Ah.
Calculer le rendement faradique ηfaradique de cette charge. Quelle est la cause de cette perte ?
Rendement : 40 / 46,8 *100 = 85,47 ~85 %.
Une partie de l'énergie électrique reçue est convertie en chaleur par effet Joule.
Calculer la masse de Plomb mPb qui se reforme au cours de cette charge totale ?
Données : MPb = 207,2 g.mol-1, Faraday 1 F = 9,65 .104 C.mol-1.
Quantité de matière d'électrons : n(e-) = Q / 96500 = 1,685 105 /96500 =1,746 mol.
Le plomb est bivalent ; quantité de matière de plomb n(Pb) =½n(e-) =0,873 mol
Masse de plomb formé : M(Pb) * n(Pb) = 207,2 *0,873 =180,9 ~181 g.
|
|
Lors d'un stationnement, les quatre feux de position, ayant chacun une puissance de 8 W, sont restés allumés 24 heures.
En supposant que les grandeurs électriques (tension et courant) ne
varient pas, calculer le courant Idécharge débité par la batterie, la
quantité de courant (Qdécharge en Ah) délivrée par la batterie en 24 h
et la valeur de l'énergie (Wdécharge en W.h) transférée aux feux de
position en 24h.
Puisance totale des 4 feux : P = 4*9=32 W.
Idécharge = P / U = 32 / 12 =2,667 ~2,7 A.
Qdécharge = Idécharge
t = 2,6667 *24=64 Ah., valeur supérieure à la capacitéde la batterie :
les feux de position ne seront pas allumés pendant 24 h, la batterie
étant déchargée au bout d'environ 40/2,7 =15 h
Wdécharge = P t = 32 *24 =768 ~7,7 102 Wh.
Le conducteur pourra-t-il démarrer normalement à son retour ?
Non ,la batterie est déchargée.
Quelle
devrait être la capacité Q’ de la batterie pour que cet incident
n'entraîne pas une décharge de plus de 50 % de l’accumulateur ?
Q' = 2*64 = 128 Ah.
|
|