|
|
|
|
Spectrophotométrie.
L'éosine est un désinfectant en solution dans l'éthanol. Une solution
alcoolique d'éosine est colorée. On place dans un spectrophotomètre une
cuve de largeur L contenant une solution d'éosine de concentration
molaire c = 1,0.10-5 mo1.L-1. A température
constante, on fait varier la longueur d'onde l et on mesure l'absorbance A, les
résultats sont regroupés sur le graphe ci-dessous :
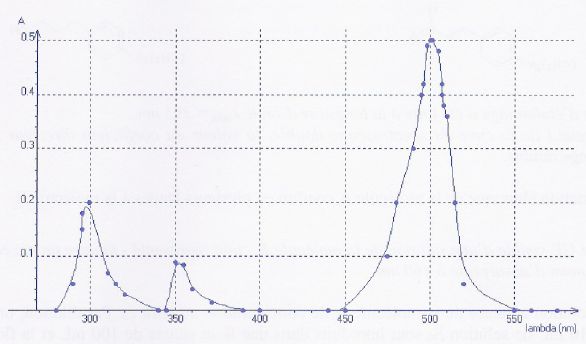
a) Deux longueurs d'onde sur trois correspondent à un maximum
d'absorption appartenant à l'infra rouge. Faux.
Les longueurs d'onde de
l'infrarouge sont supérieures à 800 nm.
b) La solution alcoolique d'éosine est de couleur cyan. Faux.
Le maximum d'absorption
se situe à 500 nm ( couleur cyan). La solution d'éosine a la couleur
complémentaire du cyan soit l'orange rosé.
c) A l = 500 nm, une
solution alcoolique d'éosine de concentration molaire c' = 1,0.10-4
mol/L a une absorbance A ' = 1. Faux.
L'absorbance est
proportionnelle à la concentration.
d) La transmittance Test une grandeur qui aurait pu être utilisée à la
place de l'absorbance. Vrai.
La
transmitance T est
définie comme le rapport de l'intensité transmise à l'intensité
incidente.
T = I / I0 ; log
T= -A.
Spectroscopie
UV visible :
L'étude spectroscopique UV-visible d'une
solution contenant la molécule A conduit au spectre de la figure 1.La
concentration molaire est c = 2,2.10-5 mo1/ L.
A température constante, on trace la courbe d'étalonnage (Figure 2) de
cette solution pour une lumière de
longueur d'onde l. Les
grandeurs physiques absorbance A et concentration molaire c sont liées
par la loi
de Beer-Lambert A = e.l.c où
e est le
coefficient d'extinction molaire et l la largeur de la cuve.
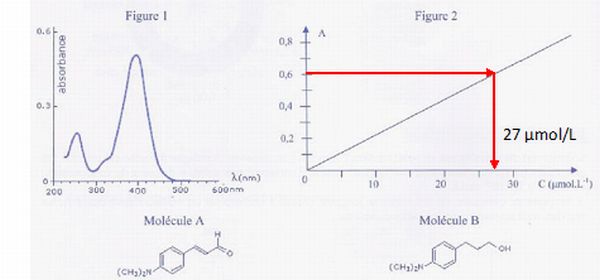
a) La courbe d'étalonnage a été faite à la longueur d'onde lmax= 395 nm. Vrai.
La longueur d'onde
d'étude correspond à un maximum d'absorption.
b) Si la largeur 1 de la cuve du spectroscope double, la valeur du
coefficient directeur de la courbe
d'étalonnage double. Vrai.
Le coefficient directeur
de cette droite est égale à e
l.
Une transformation chimique de la molécule A conduit en plusieurs
étapes à la molécule B.
c) Le spectre UV-visible d'une solution de la molécule B - non
représenté - montre un pic correspondant
à un maximum d'absorption à 460 nm.Vrai.
Dans la molécule B, le
nombre de doubles liaisons conjuguées est plus faible que dans la
molécule A. Le maximum d'absorption se trouve à une longueur d'onde
inférieure à 495 nm.
Soit S0 une solution aqueuse de la molécule A de
concentration molaire c0. Par dilution, on prépare une
solution S1 : 10 mL de solution S0 sont
introduits dans une fiole jaugée de 100 mL et la fiole jaugée est
complétée avec de l'eau distillée jusqu'au trait de jauge. Dans les
conditions opératoires utilisées pour la
courbe d'étalonnage, l'absorbance de S1 est mesurée: As=
0,60.
d) La concentration de la solution S0 est égale à 2,7.10-4
mol / L.
S1
: 27 µmol/L ou 2,7 10-5 mol/L.
Tenir compte de la
dilution au dixième : S0 : 2,7 10-4
mol/L.
|
.
|
IR.
Quatre spectres de transmittance d'espèces chimiques en phase gazeuse
sont représentés sur les documents ci-dessous.
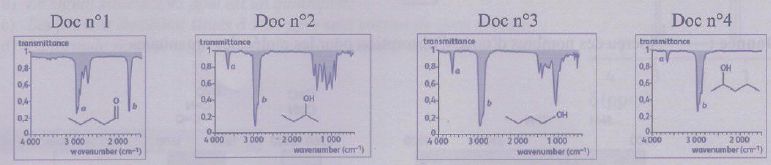
a) Sur le document n°2 (Doc n°2), la bande b a une absorption plus
élevée que la bande a. Vrai.
b) Tous ces spectres sont réalisés à des longueurs d'onde appartenant
au domaine des IR. Vrai.
c) La valeur approchée du nombre d'onde de
l'absorption relative à la liaison C = 0 vaut 3000 cm-l.
Faux.
liaison
C = 0: ~1700 cm-1.
d) Parmi les espèces chimiques, il y a deux
isomères. Vrai.
Doc n°2 et n°3 : CH3-CH2-CH(OH)
CH3 et CH3-CH2-CH2-
CH2OH.
Le terpinéol est une molécule naturelle extraite de l'essence naturelle
de pin. Il est utilisé en parfumerie pour son agréable odeur de
lilas.La formule topologique du terpinéol est donnée ci- après.
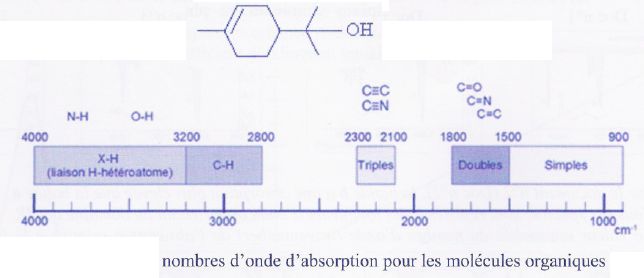
a) La formule brute du terpinéol est C10H19O.
Faux.
Le nombre d'hydrogène
doit être pair si la molécule ne comtient que les éléments C, H et O
; C10H18O.
b) Le terpinéol est un acide aminé. Faux.
Un acide aminé comporte
un groupe acide carboxylique et un groupe amine.
c) Le terpinéol possède un atome de carbone asymétrique. Vrai.

d) Le spectre ci-dessous est compatible avec la formule du terpinéol.
Vrai.
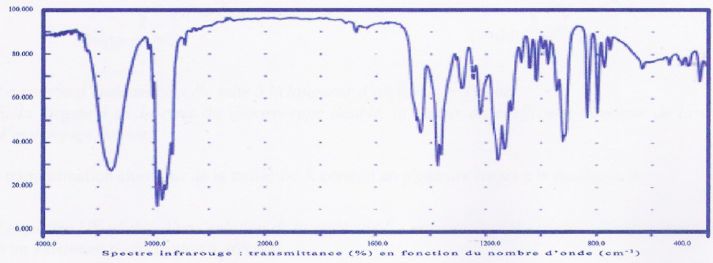
Large bande vers 3400 cm-1
: OH lié par liaison hydrogène ; vers 1500 cm-1
liaison C=C ; absence de bande caractéristique du carbonyle vers 1700 cm-1.
|
|
RMN du proton.
Le spectre de RMN d'une molécule de formule brute C3H5BrO
est représenté ci-dessous.
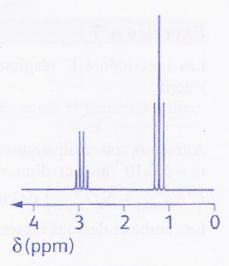
a) Il y a sept groupes d'atomes d'hydrogène
équivalents dans la molécule. Faux.
Le spectre indique deux
groupes d'hydrogène.
b) Le signal situé à 2,93 ppm est un quintuplet. Faux
Quadruplet.
c) Les protons du signal situés à 1,24 ppm sont voisins de deux
protons. Vrai.
d) La formule semi-développée de la molécule étudiée est CH3-CO-CH2-Br.
Faux.
Le spectre est caractéristique de -CH2-CH3.
Quadruplet : deux
protons couplés avec 3 hydrogènes voisins équvalents ; triplet : 3
protons couplés avec 2 protons voisins équivalents.
On cherche à identifier une
molécule de formule brute C3H7Br dont le spectre
de RMN est représenté ci-dessous. Le nombre indiqué au-dessus de chaque
signal indique un nombre de protons.
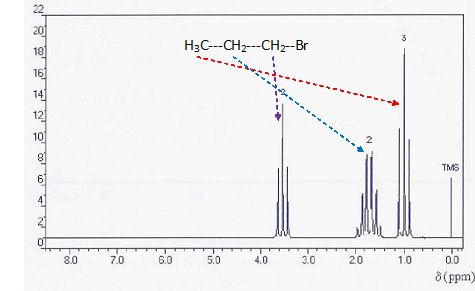
Donnée : l'électronégativité du brome est supérieure à celle du carbone.
a) Il y a trois groupes de protons équivalents. Vrai.
b) Le signal de déplacement chimique J = 1,7 ppm correspond à des
protons possédant six voisins. Faux.
c) Les protons situés sur le carbone voisin de l'atome de brome
génèrent le signal de déplacement chimique J = 3,5 ppm. Vrai.
d) Cette molécule est du 1-bromobutane. Faux.
1-bromopropane.
|
|