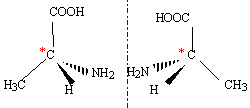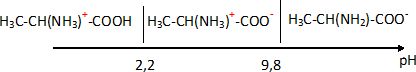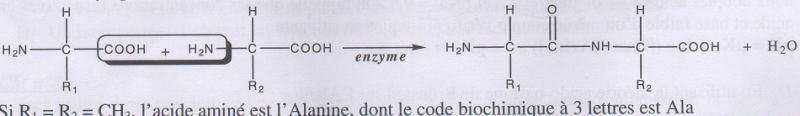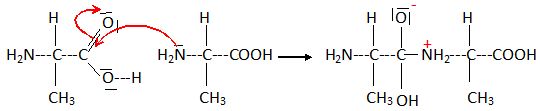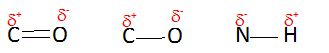|
Acide
a-aminés, alanine, formation d'un
dipeptide, penicilline, spectre IR, concours ESSA 2013.
Ecole du service de santé des armées.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
Alanine.
L'alanine existe sous trois formes ionisées
différentes en fonction du pH du milieu. Elles constituent deux couples
acide / base de pKa1 = 2,2 et pKa2 = 9,8.
Déterminer
le groupe à caractère acide et le groupe à caractère basique qu'elle
contient.
Le groupe carboxyle -COOH est à caractère acide, il peut libérer un
proton H+.
Le groupe amine NH2 est à caractère basique, il peut
accepter un proton H+.
Ecrire
la forme basique conjuguée du groupe acide et la forme acide conjuguée
du groupe basique identifiés.
Forme basique conjuguée du groupe acide : CH3-CHNH2-COO-.
Forme acide conjuguée du groupe basique : CH3-CH(+NH3)-COOH.
Ecrire
les deux couples acide / base.
Dans chaque couple la forme acide est écrite en premier, la forme base
en second.
CH3-CH(+NH3)-COOH
/ CH3-CH(+NH3)-COO- : pKa1 = 2,2.
CH3-CH(+NH3)-COO- / CH3-CHNH2-COO-
: pKa2 = 9,8.
Tracer le diagramme
de prédominance de l'alanine.
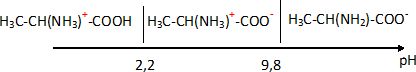
En déduire la charge
électrique de l'alanine au pH physiologique de 7,4.
La forme CH3-CH(+NH3)-COO- ( amphion) prédomine à pH = 7,4 : la charge
électrique globale de cette espèce est nulle.
On effectue le dosage direct de V0 = 20 mL d'une solution de
chlorhydrate d'alanine ( Cl- ; CH3-CH(+NH3)-COOH)
à C0 mol/L à l'aide d'une solution de soude NaOH à C1
= 0,10 mol/L.

A) Le pH
initial de la solution de soude vaut 13. Vrai. ( pH = 14 + log c1
= 14 + log 0,1)
B) Avec les 50 premiers millilitres versés, on titretoutes les
fonctions ammonium NH3+ du chlorhydrate. Faux.
C) Après avoir versé 50 mL de NaOH, la totalité des fonctions
carboxyliques sont sous forme COO-. Vrai.
D) Au niveau de la zone 2 prédomine l'alanine sous la forme CH3-CH(+NH3)-COOH.
Faux.
E) C0 = 0,04 mol/L.
A la première équivalence
C0V0 = C1V1E avec V1E
= 50 mL.
C0
= C1V1E / V0= 0,10 *50 / 20 =0,25 mol/L.
Pour
que le pH soit égal à pKa1, quelle relation
doit-on avoir entre [acide]1 et [base]1 ?
pH =pKa1
+ log( [base]1/
[acide]1.
A pH =pKa1 , [acide]1
= [base]1.
Quelles
sont les zones du document qui peuvent correspondre à cette situation
?
Zone 1 : pH =pKa1 ; zone 3 :
pH =pKa2.
Propriétés
acido-basiques de l'alanine :
A) Sa fonction acide réagit totalement avec l'eau. Faux.
B) sa forme électriquement neutre est capable d'agir soit en tant que
base soit en tant qu'acide. Vrai.
C) Un mélange équimolaire des deux espèces du couple de pKa1
= 2,2 est une solution tampon. Vrai.
D) La constante d'acidité du couple 1 vaut Ka1 = -log (2,2).
Faux. (Ka1
= 10-2,2= 6,3 10-3).
E) Une solution d'alanine de pH=6 est une solution tampon. Faux.
A propos de la
D-alanine et de la L-alanine.
A) Ce sont des molécules chirales. Vrai.
B) elles sont diastéréoisomères. Faux.
C) elles sont énantiomères. Vrai.
D) Ce sont deux conformations d'une même molécule. Faux.( on passe d'une conformation à une autre
par simple rotation autour d'une liaison simple C-C ).
E) elles sont toutes deux retrouvées au sein des protéines humaines.
Faux. ( seule la forme L est
retrouvée dans ces protéines ).
|
.
|
Formation de
peptides.
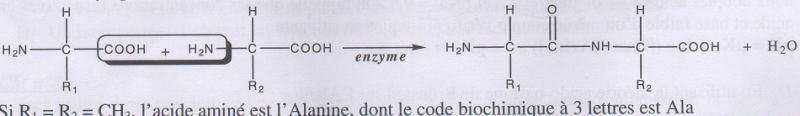
Première étape du mécanisme réactionnel de synthèse d'un dipeptide.
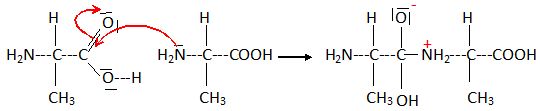
Déterminer la
polarisation des liaisons C=O, C-O et N-H.
L'oxygène
est plus électronégatif que le carbone ; l'azote est plus
électronégatif que l'hydrogène.
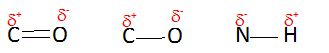
Identifier
le site donneur et le site accepteur de doublet d'électrons lors de la
formation de la liaison C-N.
L'azote est le site donneur d'électrons ; le carbone du groupe
carbonyle est le site accepteur d'électrons.
Compléter
le mécanisme en ajoutant le minimum de flèches.
Voir les deux flèches rouges ci-dessus..
Déterminer
la catégorie de la réaction.
Condensation entre un acide
carboxylique et une amine avec élimination
d'eau.
La première étape est une addition nucléophile sur l'atome de carbone
du groupe C=O, atome appauvri en électron.
|
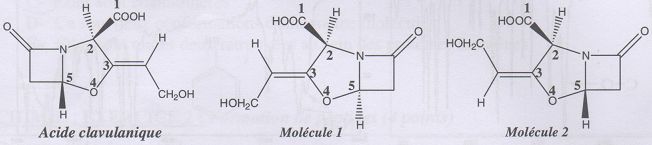
La pénicilline. 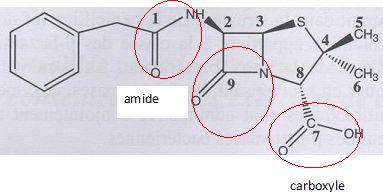
Entourer et nommer
les groupes caractéristiques.
Donner les numéros des atomes de
carbone asymétriques.
Les carbones doivent être tétragonaux et liés à 4 atomes ou groupes
d'atomes différents.
n°2, n°3, n°8.
La pénicilline est un antibiotique qui empèche la prolifération
bactérienne en bloquant la synthèse de leur paroi. Cette synthèse
nécessite l'action d'enzymes appelés transpeptidases. Ces enzymes
reconnaissent un dipeptide (D-Ala) -(D-ALa). La pénicilline est
également reconnue par ces enzymes car elle présente une analogie
structurale avec ce dipeptide. ; elle se fixe alors sur les
transpeptidases et inhibe leur action de synthèse de la paroi
bactérienne.
Quelle
partie de la pénicilline G semble être reconnue par la transpeptidase ?
La partie contenant les carbones 7, 8 et 9 et l'azote situé entre les
carbones 8 e 9..
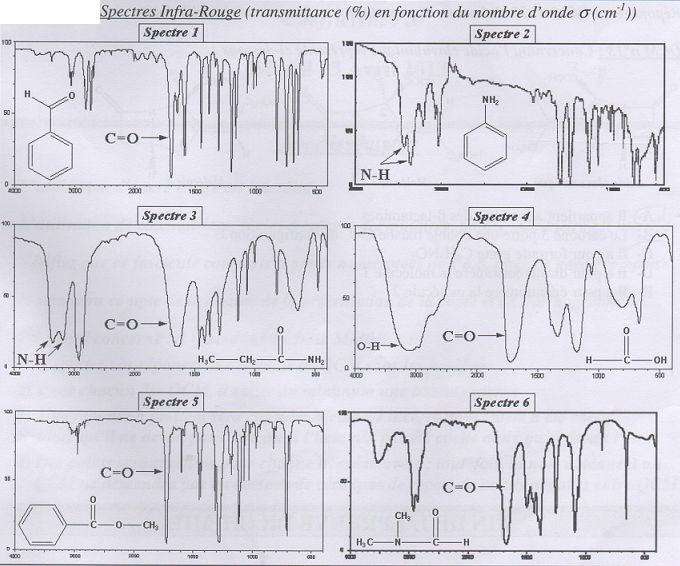
Le spectre IR de la péniciline comportera :
A) Une bande C=O comme dans le spectre 1. Faux.
B) Une bande C=O comme dans le spectre 6.
Faux.
C) Une bande N-H comme dans le spectre 3.
Vrai.
D) une bande C=O et une bande O-H comme dans le spectre 4. Vrai.
E) une bande N-H comme dans le spectre 2. Faux.
|
|