|
|
|
|
La
pâte contient encore un peu de lignine. Pour optimiser les opérations
de blanchiment du papier, on mesure la quantité de la lignine restante.
On détermine alors l'indice Kappa qui caractérise la blancheur de la
pâte.
Le mode opératoire consiste à oxyder la lignine restante par un excès
d'oxydant puissant : les ions permanganate en milieu acide. Les ions
permanganate restants sont dosés en retour par iodométrie.
Les réactions mises en jeu sont les suivantes :
2MnO4- + 10I- +16H+---> 2Mn2+ +5I2 +8H2O.
I2 +2S2O32- ---> S4O62- + 2I-.
Protocole opératoire :
Etape 1 : on recouvre la pâte avec un volume V1 = 100 mL de permanganate acidifié à c1 = 0,020 mol/L ;
étape 2 : on laisse le temps de la réaction. On note c2 la concentration du permanganate après la réaction, le volume n'ayant pas changé par ailleurs ;
étape 3 : on ajoute à la solution précédente, 25 mL d'iodure de potassium de concentration c3 = 0,50 mol/L ;
étape 4 : on réalise le dosage du diiode formé par le thiosulfate de sodium de concentration c4 = 0,20 mol/L.
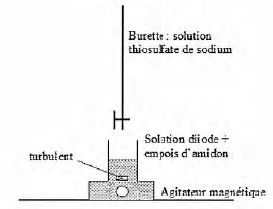
Sur chaque poste de travail les élèves disposent :
- d'un becher contenant 3 g de pâte ;
- d'un volume V1 = 100 mL de solution de permanganate acidifié à 0,020 mol/L ;
- d'une bouteille de 1 L d'iodure de potassium à 0,50 mol/L ;
- d'une bouteille de 1 L de thiosulfate de sodium à 0,20 mol/L ;
- d'un flacon rempli d'empoi d'amidon ;
- de la verrerie et de l'appareillage nécessaires.
Indiquer les précautions de sécurité à prendre ( protection individuelle ).
Port de blouse, gants et lunette de protection.
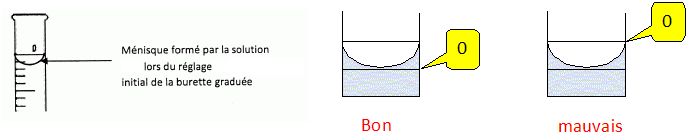
Indiquer les actions successives que doivent réaliser les élèves pour remplir la burette.
Fermer
le robinet, verser la solution de permanganate dans un becher et
remplir la burette en dépassant légèrement le "zéro". Mettre le becher
sous la burette, ouvrir le robinet afin d'ajuster au zéro.
|
.
|
Indiquer le rôle de l'empois d'amidon.
Indicateur de fin de réaction : en présence d'empois d'amidon, le diiode donne une coloration violette foncé à la solution.
Indiquer pourquoi le permanganate de potassium doit être acidifié.
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O.
MnO4- peut être réduit en ion Mn2+ seulement en milieu acide.
Calculer la quantité minimale d'iodure de potassium, notée Vmin, à mettre en solution.
Quantité de matière d'ion permanganate restant ( en excès) : c2V1.
2MnO4- + 10I- +16H+---> 2Mn2+ +5I2 +8H2O.
D'après les nombres stoechiométriques : n(I-) = 5 n(MnO4-) = 5 c2V1 =Vminc3 ;
Vmin= 5 c2V1 /c3 = 5*1,92 10-2 *0,100/ 0,50 =1,92 10-2 L ~19 mL.
Le volume de thiosulfate équivalent Véq = 24 mL. Calculer :
le nombre de moles nI2 de diiode à la fin de l'étape 3.
I2 +2S2O32- ---> S4O62- + 2I-.
nI2 = ½n(S2O32-) =c4Véq = 0,20 *24 10-3 = 4,8 10-3 mol.
Le nombre de moles d'ion permanganate, noté n2, présents à la fin de l'étape 2.
2MnO4- + 10I- +16H+---> 2Mn2+ +5I2 +8H2O.
D'après les nombres stoechiométriques : n2 = 0,4 n(I2) = 0,4*4,8 10-3 = 1,92 10-3 ~1,9 10-3 mol.
La concentration c2.
c2 = n2 / V1 =1,92 10-3 / 0,100 = 1,9 10-2 mol/L.
L'indice Kappa se détermine à l'aide de la relation suivante : 2(50-Véq) / masse de pâte.
Véq en mL et masse en g.
Calculer l'indice Kappa de l'échantillon testé.
(50-24) / 3 ~8,7.
L'indice Kappa détermine la nature du traitement à appliquer à la pâte en vue de son blanchiment.
Si
cet indice est supérieur à 12, la séquence de blanchiment de la pâte
sera ECF ( Exempt de Chlore Elémentaire ). Cette séquence utilise du
dioxyde de chlore néfaste pour l'environnement.
Si l'indice Kappa
est inférieur à 12, la séquence de blanchiment de la pâte sera TCF (
Totalement Exempt de Chlore ). Elle utilise le peroxyde
d'hydrogène et l'ozone, et ne rejettent pas de chlore dans les
effluents.
|
|

