|
|
|
|
Connaissances
générales.
Proposer
une définition des notions suivantes :
Energie fossile
: le pétrole, le charbon, le gaz sont des énergies fossiles. Ils se
sont formés il y a très longtemps sur terre et ne renouvellent
pas de nos jours. Leur utilisation épuisent leur réserves.
Energie renouvelable : le vent, le soleil, les marées sont des énergies
renouvelables. Ils se renouvellent sans cesse sur terre et leur
utilisation n'épuisent aucune réserve.
Donner
les formules semi-développées des différents composés chimiques suivants
:
Dihydrogène : H2 ; méthane : CH4 ; acide
éthanoïque : CH3-COOH ; acétone : CH3-CO-CH3
; alcool méthylique ou méthanol : CH3-OH.
Proposer
une définition des réactions chimiques suivantes :
La pyrolyse : décomposition d'un composé organique par la chaleur pour
obtenir d'autres produits qu'il ne contenanait pas.
L'hydrolyse : décomposition d'une substance ou coupure d'une
molécule par action de l'eau.
Ecrire
la réaction de transformation de l'éthanol en éthène. préciser de quel
type de réaction il s'agit.
CH3-CH2OH ---> CH2=CH2 +
H2O. Réaction d'élimination d'une molécule d'eau.
Le
glucose.
La cellulose ( 40 à 50 % du bois ) est un polymère formé de longues
chaînes de molécules de glucose.
Le glucose ( C6H12O6) est formé par
les végétaux à partir de l'eau et du dioxyde de carbone de l'air, en
présence de lumière.
Ecrire
et équilibrer l'équation de la réaction ci-dessus.
6CO2 + 6H2O ---> C6H12O6 + 6O2.
Quel
est le nom du processus biologique mis en jeu dans cette réaction ?
La photosynthèse du glucose.
Comment
nomme-t-on une réaction qui absorbe de l'énergie sous forme thermique
lorsqu'elle se produit ?
Une réaction endothermique.
Proposer
deux expériences différentes illustrant un dégagement d'énergie sous
forme thermique au cours d'une réaction.
Une combustion ( du bois par exemple ) ; une réaction acido-basique
avec des réactifs assez concentrés.
La molécule de glucose existe sous deux formes
tautomères, l'une cyclique, l'autre ouverte.
Reproduire
la forme cyclique de la molécule de glucose en y faisant figurer, par
leur symbole, tous les atomes la constituant. Indiquer, à l'aide de la
représentation de Fischer, le nombre et le nom des fonctions chimiques
présentes dans cette molécule dans sa forme ouverte.
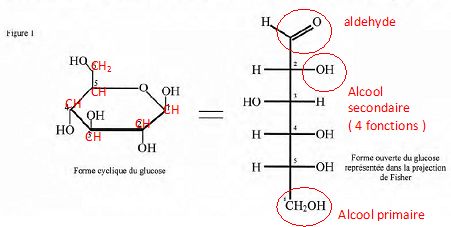
Justifier
le fait que le glucose soit soluble dans l'eau à 20°C.
La molécule de glucose, du fait de la présence de plusieurs fonctions
oxygénées, est polaire. L'eau est également un solvant polaire.
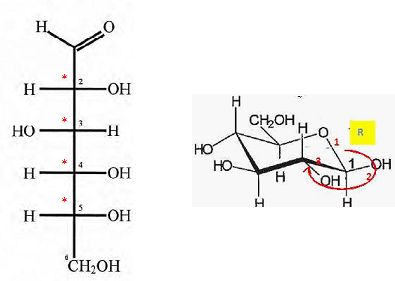
Reproduire
la représentation du glucose dans la projection de Fischer en y
indiquant, à l'aide d'astérisques, les carbones asymétriques. Donner la
configuration absolue ( R ou S) du carbone n°2.
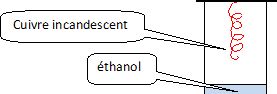
On réalise l'oxydation ménagée d'un alcool par l'expérience dite de la
lampe sans flamme.
Schématiser
cette expérience.
Un fil de cuivre incandescant,
en forme de tire bouchon, est placé au dessus d'un becher contenant un peu d'éthanol.
Le fil
incandescant crée des courant de convexion dans le becher ; l'oxydation
de l'éthnol par l'oxygène de l'air est une réaction exothermique : le
fil reste incandescent et on sent une odeur de pomme verte ( éthanal).
Le produit obtenu est testé. Le test est positif à la DNPH et négatif
avec la liqueur de Fehling.
Indiquer
à quelle famille appartient le produit obtenu par oxydation ménagée de
l'alcool et en déduire la classe de l'alcool.
Le test négatif à la liqueur de Fehling élimine un aldehyde et donc
comme réactif un alcool primaire.
Le test positif à la DNPH et négati fà la liqueur de Fehling conduit à
l'existence d'une cétone et en conséquence à un réactif, un alcool
secondaire.
|
.
|
La cellulose.
Le bois contient environ 50 % de cellulose de formule brute (C6H10O5) n avec 3500< n <10000.
Indiquer ce que représente n.
Indice de polymérisation ou nombre moyen de motif élémentaire dans le polymère.
Calculer la masse molaire, notée M de cette macromolécule. Prendre n = 5000.
M = 5000(6*12+10+5*16) =8,1 105 g/mol.
La cellulose et l'amidon sont des polymères tous deux formés d'une longue chaîne de molécules cyclique de glucose.
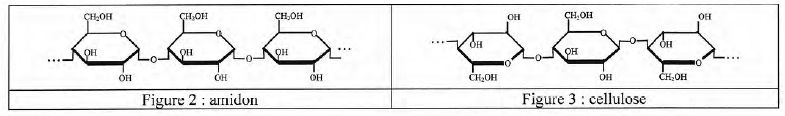
Le carbone n°1 de la forme cyclique du glucose, est un centre
d'asymétrie. Il existe donc deux stéréoisomères de cette forme : l'a-glucose et le ß-glucose, représenté sur la gigure 1 ci-dessus. Représenter l'a-glucose.
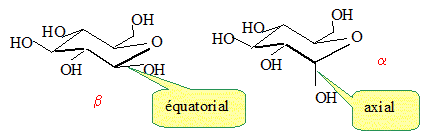
A l'aide des figures 2 et 3, préciser la différence entre la cellulose et l'amidon.
Les liaisons entre les glucoses de la cellulose sont du type béta
1-4 ; les liaisons entre les glucoses de l'amidon sont du typae alpha
1-4.
La molécule de cellulose est représentée par la répétition d'un dimère appelé "cellobiose".
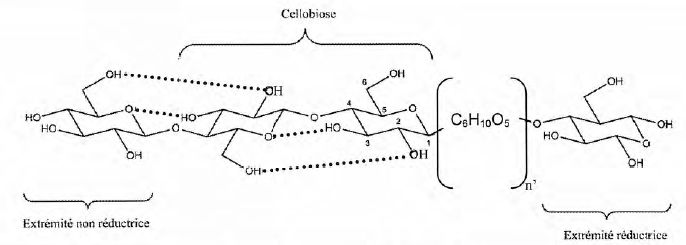
Donner, à l'aide de ce dimère, la formule semi-développée de la cellulose (C6H10O5)5000.
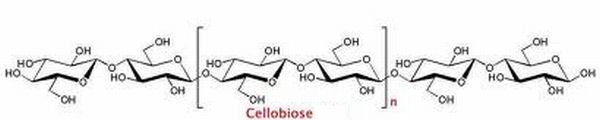
avec n = 2498.
Cette polymérisation est-elle une polycondensation ou une polyaddition ? Justifier.
Polycondensation : les molécules de glucose se combinent avec élimination de molécules d'eau.
Justifier le caractère réducteur de l'extrémité réductrice du polymère.
Cette extrémité réductrice est la forme cyclique du glucose dont la
forme ouverte possède une fonction aldehyde réductrice.
Sur la figure, les liaisons en pointillés représentent des liaisons hydrogène.
Préciser l'origine de cette liaison hydrogène.
L'atome
d'oxygène est bien plus électronégatif que l'atome d'hydrogène ; de
plus l'atome d'oxygène possède deux doublets non liants.
La cellulose permet au bois de retenir l'eau. Justifier le caractère hydrophile de la cellulose.
La présence des fonctions hydroxyles
donne à la cellulose des propriètés hydrophiles qui lui permet de fixer
un grand nombre de molécules d'eau par liaisons hydrogène.
Le glucose est soluble dans l'eau alors que la cellulose ne l'est pas. Proposer une explication.
La cellulose est une macromolécule constituée d'une longue structure carbonée. Le glucose est un monomère.
|
|
Le papier, le procédé Kraft.
Le
procédé Kraft est le procédé chimique le plus courant. Des copeaux de
bois subissent une cuisson en milieu alcalin, par une solution de soude
et de sulfure de sodium, à environ 170°C, pendant 2 à 5 heures. La
lignine réagit avec les différents composés soufrés pour donner des
thiolignines plus facilement solubles. La pâte à papier, contenant les
fibres de cellulose, est séparée du liquide de cuisson ( la liqueur
noire ) qui est ensuite régénérée en liqueur blanche.
La liqueur blanche de ce procédé contient une solution de soude et des ions sulfures..
Décrire la préparation en laboratoire d'un litre de solution d'hydroxyde de sodium à 150 g/L.
Port de blouse, gants et lunette de protection : les pastilles de soude étant caustiques.
Peser
sur une balance 150 g de pastilles de soude. Les verser dans une fiole
jaugée de 1,00 L contenant environ 1/3 d'eau distillée. Agiter jusqu'à
dissolution complète. Compléter la fiole jaugée jusqu'au trait de jauge
à l'aide d'eau distillée. Agiter pour rendre homogène.
L'ion sulfure est une dibase faible.
Ecrire l'équation modélisant sa réaction avec l'eau.
S2-aq + H2O(l)=HS-aq + HO-aq. (1)
HS-aq+ H2O(l)=H2Saq + HO-aq. (2)
Bilan : S2-aq + 2H2O(l)=H2Saq + 2HO-aq. K = [H2Saq][HO-aq]2 / [S2-aq].
Exprimer puis calculer ( à 25°C ) la constante d'équilibre K de cette réaction en fonction des espèces prédominantes présentes en solution.
H2S / HS- pKa1 = 6,9 ; HS- / S2- pKa2 = 12,0.
Ka1 =[HS-][H3O+] / [H2S] ; Ka2 =[S2-][H3O+] / [HS-]. Ka1 Ka2 =[H3O+]2[S2-] / [H2S].
K = [H3O+]2[HO-aq]2 / (Ka1 Ka2) = Ke2 /(Ka1 Ka2) = 10-28 / (10-6,9 10-12) =10-9,1.
Tracer le diagramme de prédominance des espèces en fonction du pH.
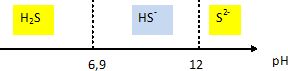
Un échantillon de liqueur blanche est prélevé. Le pH mesuré vaut 13,5.
Calculer le rapport [S2-] / [H2S]. [S2-] / [H2S] = Ka1 Ka2 =[H3O+]2 = 10-18,9 / 10-27 = 108,1.
A pH supérieur à pKa2, S2- est très majoritaire devant H2S.
La liqueur noire de ce procédé est concentrée dans les évaporateurs, reçoit un apport de sulfate de sodium, puis est calcinée.
Donner le nombre d'oxydation du soufre dans SO42- et dans S2-. Précise l'oxydant et le réducteur du couple redox constitué par ces deux espèces.
Ion sulfate : n.o(S )+4*(-2) = -2 ; n.o(S) = + VI ; ion sulfure : n.o(S) = -II.
SO42- / S2- : l'ion sulfate constitue l'oxydant ; l'ion sulfure constitue le réducteur.
Lors du procédé industriel, le sulfure est régénéré par réduction des
ions sulfate avec le carbone. Cette réaction produit un dégagement de CO2.
Ecrire l'équation de cette réaction.
SO42- + 2C ---> S2- + 2CO2.
La liqueur verte du procédé Kraft contient essentiellement du carbonate de sodium Na2CO3 et du sulfure de sodium Na2S. Pour régénérer la soude et éliminer les ions carbonate, on ajoute de l'hydroxyde de calcium Ca(OH)2. Ecrire la réaction de précipitation du carbonate de calcium CaCO3.
Na2CO3 +Ca(OH)2 --->CaCO3(s) +2NaOH.
Calculer la concentration molaire [Ca2+] dans une solution saturée en CaCO3. pKs(CaCO3) = 8,3.
Ks = [Ca2+][CO32-] avec [Ca2+]=[CO32-] = Ks½ = 10-4,15=7,1 10-5 mol/L.
100 m3 de liqueur verte contenant 90 g/L de carbonate de sodium sont traité quotidiennement par ajout d'hydroxyde de calcium.
Calculer la masse d'hydroxyde de calcium à introduire par jour.
Masse de Na2CO3 : 90*100*1000 = 9,0 106 g. M(Na2CO3) =106 g/mol ;
n(Na2CO3) =n(Ca(OH)2=9,0 106 / 106 =8,5 104 mol.
Masse de Ca(OH)2=8,5 104 M(Ca(OH)2) = 8,5 104 *74,1 =6,3 106 g = 6,3 t.
Le carbonate de calcium récupéré est envoyé dans un four à chaux pour
être calciné. La chaux vive obtenue CaO est immergée dans un grand
volume d'eau pour former l'hydroxyde de calcium selon la réaction :
CaO + H2O ---> Ca(OH)2.
Calculer l'enthalpie de cette réaction et conclure.
DrH° = DfH°(Ca(OH)2) - DfH°(H2O)- DfH°(CaO) = -986,6 -(285,8-635,5) =-65,3 kJ / mol.
DrH° <0, cette réaction est exothermique.
|
|







