Détermination de
la teneur en fer du Timoférol , échelle de teintes, spectrophotométrie.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
.
.
|
|
|
|
|
|
L'étiquette
du médicament est reproduite :
Sulfate ferreux :172,73 mg soit fer : 50 mg
acide ascorbique ( vitamine C) : 30 mg
magnésium carbonate ; talc ; silice ; amidon de maïs ; enveloppe de la
gelule : gélatine, titane dioxyde, bleu patenté, jaune de quinoléïne.
Les ions Fe2+ présents dans le sulfate ferreux FeSO4
et la vitamine C constituent les principes actifs du médicament.
Quel nom donne-t-on
à l'ensemble des autres espèces chimiques présentes dans le médicament
?
Les excipients
désignent toute substance autre que le principe actif.
Quels
sont les rôles du bleu patenté et du jaune de quinoléïne ?
La gelule est bleu et jaune avec l'inscription timoférol.
Donner
les formules brutes du carbonate de magnésium et de la silice.
MgCO3 ; SiO2.
Pour déterminer la teneur en ion Fe2+ dans le médicament,
une échelle de teintes est proposée aux élèves.
Préparation
de l'échelle de teintes.
Une solution mère de concentration massique en ion ferreux ( Fe2+)
C0m =280 mg/L est proposée aux élèves.
Cette solution est préparée à partir du sel de Mohr. Il est nécessaire
d'ajouter quelques gouttes d'acide sulfurique à la solution.
Quel est le rôle de
cet ajout ?
En milieu acide, on évite la précipitation de l'hydroxyde ferreux Fe(OH) 2.
Les élèves sont invités à préparer, dans des fioles jaugées de 100,0
mL, sept solutions de concentrations massiques en ion fer (II)
indiquées dans le tableau suivant.
Solution
|
S1
|
S2
|
S3
|
S4
|
S5
|
S6
|
S7
|
[Fe2+]
mg/L
|
28,0
|
22,4
|
16,8
|
11,2
|
8,40
|
5,60
|
2,80
|
Ils ajoutent ensuite à chaque solution, 1,0 mL d'hexacyanoferrate III
de potassium à 25,0 g/L soit 7,59 10 -2 mol/L.
Pourquoi
ne pas plutôt ajouter une solution de cyanure de potassium ( K+ +CN- ) à la solution
d'ion fer II ?
En milieu acide, l'ion cyanure conduit à la formation de cyanure
d'hydrogène HCN, gaz très toxique.
Citer deux
compétences que la préparation de cette échelle de teintes met en oeuvre.
Préparer une solution de concentration donnée par dissolution et
dilution.
Connaître et exploiter l'expression des concentrations molaire et
massique d'une espèce dissoute.
Pratiquer une démarche expérimentale pour déterminer la concentration
d'une espèce.
|
|
|
Exploitation
directe de l'échelle de teintes en classe de seconde.
Le
protocole de dissolution d'une gélule de Timoférol proposé aux élèves
est le suivant :
Placer le contenu d'une gélule dans une fiole jaugée de 100,0 mL.
Ajouter de l'eau distillée au 3/4 de la fiole et agiter.
Compléter au trait de jauge avec de l'acide sulfurique concentré.
Expliquer
pourquoi la dissolution du carbonate de magnésium est améliorée en
milieu acide.
MgCO3(s) = Mg2+aq + CO32-aq.(1)
En milieu acide : CO32-aq
+H+aq = HCO3-aq : l'équilibre (1) est
déplacé dans le sens direct.
Expliquer la
nécessité de diluer au 1/50ème la solution obtenue
avant d'effectuer le dosage. On obtient une solution notée ST.
La concentration da la solution ainsi préparée est voisine de 50 mg de
fer dans 100 mL soit 500 mg/L en ion fer II.
Après dilution au 1/50ème, la concentration de la solution ST
est de l'ordre de 10 mg/L d'ion fer II, valeur qui appartient à
l'échelle de teintes.
Comment
procède-t-on pour réaliser le dosage par échelle de teintes ? Donner le
résultat attendu sous la forme d'un encadrement de la masse m d'ion fer
II dans la gélule.
Comparer la couleur de la solution ST à l'échelle de teintes
; la teinte de la solution ST est comprises entre celles des
solutions 4 et 5 : 8,4 < m < 11,2 mg/L.
|
.
|
|
Exploitation
spectrophotométrique de l'échelle de teintes en terminale S.
Un professeur souhaite adapter cette activité pour une classe de
terminale S afin de déterminer avec davantage de précision la quantité
d'ion fer II présente dans une gélule. Il décide de conserver la
méthode de dissolution de la gélule décrite ci-dessus et prévoit de
doser la solution obtenue. Le professeur projette d'effectuer un dosage
par étalonnage des ions fer II en utilisant un spectrophotomètre et
l'échelle de teintes préparée par les élèves de seconde. Pour éviter
une saturation du spectrophotomètre il est nécessaire de diluer les
solutions Si et la solution ST d'un facteur 4,00
; on obtient ainsi les solutions S'i et S'T.
Le spectre visible de la solution S'1 présente un maximum
d'absorption pour une longueur d'onde de 690 nm.
Ce maximum est-il
compatible avec la couleur bleue observée ? Justifier.
L'absorbance est maximum pour la couleur complémentaire du bleu, teinte
de la solution. Ce maximum est donc compatible.
Les élèves mesurent l'absorbance A de chaque solution à 690 nm.
Solution
|
S'1
|
S'2 |
S'3 |
S'4 |
S'5 |
S'6 |
S'7 |
S'T |
A
|
0,516
|
0,409
|
0,315
|
0,217
|
0,152
|
0,101
|
0,050
|
0,179
|
[Fe2+]
mg/L
|
28,0
/ 4 = 7,00
|
5,60
|
4,20
|
2,80
|
2,10
|
1,40
|
0,700
|
??
|
| A
/ [Fe2+] |
0,0737
|
0,0730
|
0,0750
|
0,0775
|
0,0724
|
0,0721
|
0,0714
|
|
Exploiter les
résultats du tableau pour déterminer la messe de fer dans la gélule de
Timoférol.
A / [Fe2+]
=0,0736 ; par suite [Fe2+]T ' =0,179 /
0,0736=2,43 mg/L.
Enfin , en tenant compte de la dilution d'un facteur 4 :[Fe2+]T
=4,00 [Fe2+]T ' =4,00*2,43 = 9,77 mg/L.
Le
professeur s'interroge sur la nature de la réaction entre les ions fer
II et les ions Fe(CN)63- qui conduit à la
formation d'un produit soluble donnant une couleur bleue à la solution.
La figure ci-dessous représente les spectres d'absorption de la
solution S'i contenant initialement les deux réactifs aux
concentrations apportées indiquées sur les graphes.
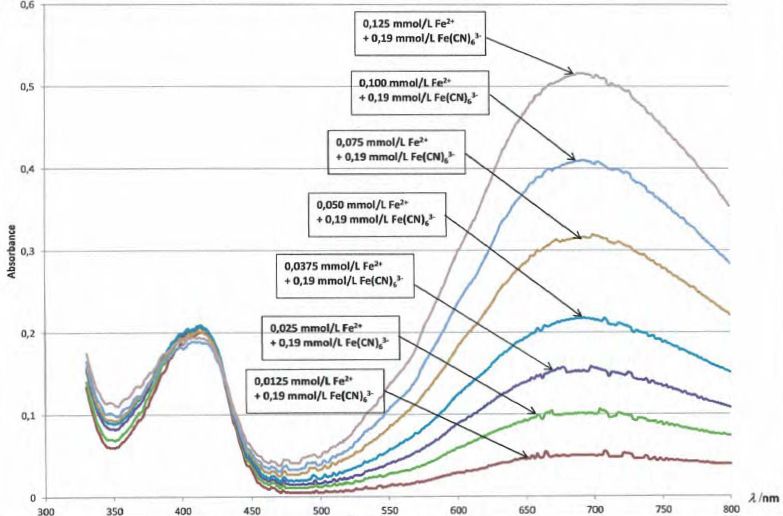
|
La
figure suivante présente les spectres de la solution S'1 et
de la solution ne contenant que l'hexacyanoferrate de potassium, à même
concentration apportée que dans la solution S'i.
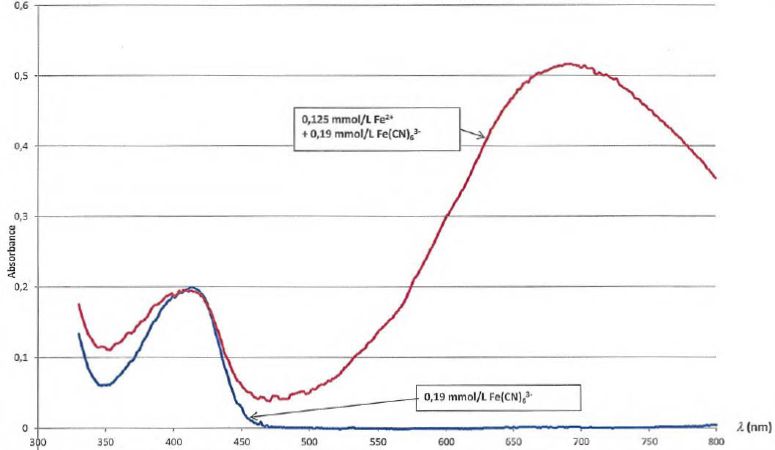
Au cours de sa consultation de la littérature, le professeur trouve
deux réactions possibles entre les ions Fe2+ et Fe(CN)63-
conduisant à la formation de produitd solubles.
Réaction 1 : Fe2+
+ Fe(CN)63- = Fe3+
+ Fe(CN)64- .
Réaction
2 : Fe2+
+ Fe(CN)63- =
Fe2(CN)6- .
Il envisage 4 hypothèses pour interpréter ses observations.
A : réaction 1 peu avancée ; B : réaction 1 très avancée ; C : réaction
2 peu avancée ; D : réaction 2 très avancée.
Confronter
les 4 hypothèses aux résultats expérimentaux et indiquer celle qui vous
paraît convenir en justifiant.
L'ion
Fe(CN)63-
( couleur rouge ) n'absorbe pas à 690 nm mais présente un maximum
d'absorption dans le bleu (
vers 415 nm ).
L'ion Fe(CN)63-
est en large excès devant l'ion fer II : on observe une absorbance
pratiquement constante vers 415 nm, quelle que soit la concentration en
ion fer II.
L'ion
Fe(CN)64-
( couleur bleue ) absorbe 690 nm.
L'absorbance et la concentration en ion Fe(CN)64-
sont proportionnelles.
Fe2+ aq + Fe(CN)63-aq
= Fe3+ aq + Fe(CN)64-aq
: il y a formation de bleu de Prusse Fe4[Fe(CN6)]3
selon une réaction rapide et très avancée d'échange de ligands.
Le bleu de Prusse est peu
soluble dans l'eau.
|
|