Artémisinine et
trioxaquines, synthèse organique : Capes physique chimie 2013.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
On s'intéresse à quelques étapes de la synthèse du DU-1202.
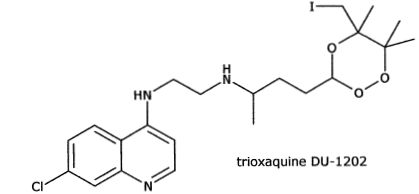 Pourquoi les trioxaquines sont-elles appelées molécules "hybrides" dans le contexte de la lutte contre le paludisme ?
Ces molécules associent deux motifs actifs : un
trioxane, alkylant potentiel de l’hème et/ou des protéines parasitaires
de Plasmodium, et une amino-quinoléine susceptible de s'accumuler dans
le parasite.
Pourquoi les trioxaquines sont-elles appelées molécules "hybrides" dans le contexte de la lutte contre le paludisme ?
Ces molécules associent deux motifs actifs : un
trioxane, alkylant potentiel de l’hème et/ou des protéines parasitaires
de Plasmodium, et une amino-quinoléine susceptible de s'accumuler dans
le parasite.
Etape I--> J :
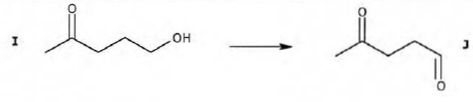
Donner en nomenclature officielle, les noms des molécules I et J.
I : 5-hydroxypentan-2-one ; J : 4-oxopentanal.
Proposer un réactif permettant de réaliser cette transformation I en J.
Oxydation ménagée d'un alcool primaire à l'aide de permanganate de potassium en défaut, en milieu acide. Les aldehydes étant en généralt plus volatils que les alcools ( ils ne forment pas
de liaison hydrogène)on peut distiller l'aldéhyde au fur et
à mesure de sa formation.
Proposer
une technique spectroscopique permettant de différencier simplement les
molécules I et J. Justifier succinctement votre choix.
Spectroscopie IR : l'alcool I présente une large bande vers 3000 - 3500 cm -1 ( liaison OH associée par liaison hydrogène ). La molécule J présentera une bande fine supplémentaire vers 1720 -1740 cm -1( liaison C=O ) et une bande vers 2850 cm -1 ( liaison C ald-H ).
|
|
|
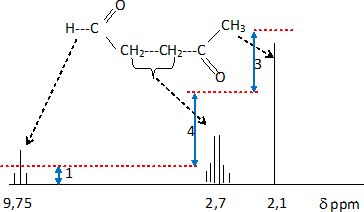
La caractéristique de J par spectroscopie RMN du proton est donnée comme suit :
1 H RMN ( 250 MHz, CDCl3) d, ppm (2,14 singulet, 3H ), 2,70 ( multiplet non résolu, 4 H) , 9,75 ( triplet, 1 H ).
A quelle grandeur la valeur 250 Hz fait-elle référence ?
Pour observer le basculement des vecteurs
moments magnétiques et la transition entre les niveaux d'énergie,
il faut appliquer un champ magnétique ayant la fréquence dite de " Larmor".
Donner
l'allure du spectre RMN et de la courbe d'intégration. Attribuer chacun
des signaux aux protons ou groupes de protons de la molécule.
Le rendement de cette synthèse n'est que de 58 %. L'un des sous-produits identifiés est J'.
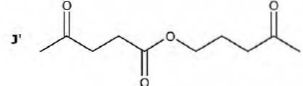
Proposer une explication pour la formation de ce sous-produit.
L'oxydation ménagée de l'alcool primaire peut aller au stade acide
carboxylique. Ce dernier peut estérifier l'alcool primaire de départ.
|
.
Stéréosélectivité de l'étape.
Justifier qu'à la formule topologique de M puissent correspondre deux couples d'énantiomères.
La molécule M possède deux atomes de carbone asymétriques.
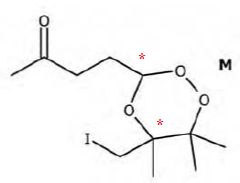
L'un des couples est majoritaire devant l'autre dans un rapport de 5
pour 1. Les auteurs justifient cette stéréosélectivité par la plus
grande stabilité d'un des couples. On considère les deux
diastéréoisomères ci-dessous :
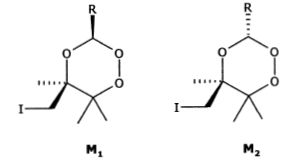
On suppose que comme les cyclohexanes, les conformations les plus stables de ces molécules sont les conformations "chaise".
Compléter le schéma en représentant les deux conformations chaise en équilibre pour chacune des deux molécules M1 et M2.
Le passage d'une conformation chaise à une autre, inverse les positions axiales
et équatoriales.
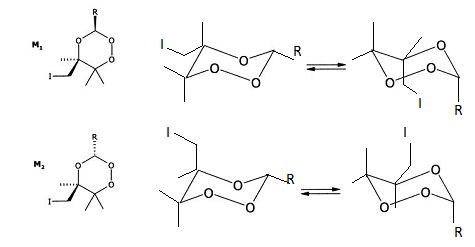
Si la réaction est sous contrôle thermodynamique, quel sera de M1 ou M2 le produit majoritaire ? Justifier.
Le produit majoritaire est le plus stable. Le composé le plus
stable est celui pour lequel les substituants les plus volumineux se
trouvent en position équatoriale ( M1).
|
|