|
|
Spectrophotométrie
d'absorption.
Les ions nitrate sont d'abord réduite en ions nitrite par passage de la
solution dans une colonne de chromatographie contenant des grains de
cadmium recouverts de cuivre. Les ions nitrite obtenus réagissent en
milieu acide ( sous forme d'acide nitreux ) avec le sulfanilamide ou
4-aminobenzène sulfonamide pour former un sel de diazonium qui subit un
couplage avec le NED ou N-(1-Naphtyl)EthylèneDiamine. On obtient enfin
un composé diazoïque de couleur rose susceptible d'être dosé par
spectrophotométrie d'absorption moléculaire.
Mode
opératoire.
Un échantillon d'eau de ville est traité sur la colonne Cu/Cd,puis est
recueilli dans un becher. On prélève 5,00 mL de cette solution qu'on
introduit dans une fiole jaugée de 100,0 mL, notée X. On y ajoute 1 mL
de réactif de diazotation, en excès, qui permet la transformation
totale des ions nitrite en composé diazoïque et on complète jusqu'au
trait de jauge avec de l'eau distillée.
Une solution étalon à 20,00 mg/L d'ion nitrate subit la même réduction
sur la colonne Cu/Cd et la solution réduite permet de préparer une
série de fioles jaugées de 100,0 mL notées 1, 2, 3 et 4 selon les
mélanges suivants :
| Fiole |
0 |
1 |
2 |
3 |
4 |
X |
| volume
de solution réduite (mL) |
0,00 |
2,00 |
4,00 |
6,00 |
8,00 |
5,00 |
| Réactif
de diazotation ( mL) |
1 |
| eau
distillée |
Q s p 100,00 mL |
| absorbance
A |
0,000 |
0,251 |
0,524 |
0,732 |
1,031 |
0,657 |
| t
: titre en ion nitrate mg/L. |
0 |
20*2/100
=0,400 |
0,800 |
1,20 |
1,60 |
|
| A
/ t |
xxxx |
0,251/0,40
=0,628 |
0,655 |
0,610 |
0,644 |
|
Après 15 minutes d'attente, une partie
de la solution contenue dans chaque fiole jaugée est
transférée dans une cuve de longueur L=l = 1,00 cm qui est placée dans
le spectrophotomètre. Les absorbances sont mesurées à la longueur
d'inde l=540
nm et les résultats de mesure pour chaque solution sont indiqués dans
le tableau.
Comment la
longueur d'onde l=540
nm a-t-elle été choisie ?
Pour une meilleure sensibilité, on choisit une longueur d'onde pour
laquelle la solution présente un maximum d'absorption. La couleur
correspondante à 540 nm est la teinte complémentaire de la solution
rose.
La solution étalon d'ions nitrate à 20,00 mg/L a été préparée à partir
de nitrate de potassium pur.
Proposer
un mode opératoire pour prépparer 200,0 mL de cette solution.
Peser 20,00 *200 / 1000 = 200,00 / 5 = 4,00 mg de solide KNO3
sur une balance de précision.
Placer un entonnoir sur une fiole jaugée de 200,0 mL, y verser le
solide, rincer coupelle de pesée et entonnoir à l'eau distillée.
Compléter la fiole jaugée jusqu'au trait de jauge avec de l'eau
distillée. Boucher et agiter pour rendre homogène.
Donner
la définition de l'absorbance d'un échantillon
Lorsqu'une
lumière monochromatique d'intensité I0 traverse
un milieu homogène, l'intensité de la lumière émergente I décroît
exponentiellement lorsque l'épaisseur l du milieu absorbant augmente.
I = I0
. e (- al)
a est une constante appelée coefficient d'absorption,
caractéristique du milieu et de la longueur d'onde considérés.
Dans le cas des solutions, la loi de Beer fait intervenir les
concentrations.
I = I0
. e (- elc)
où e est un coefficient
caractéristique de la substance appelé coefficient d'absorbance (L
mol-1 cm-1),
l est l'épaisseur
de la cuve (cm) et c
la concentration de la solution (mol/L).
Cette loi est vérifiée lorsque la solution est de concentration
inférieure à : c < 0,1 mol.L-1.
La relation fondamentale utilisée en spectrophotométrie est présentée
sous la forme :
A= log (I0/I)
= elc ( A est l'absorbance
ou densité optique)
e est une caractéristique de la
molécule. Plus e sera grand, plus la solution
absorbe.
|
La loi de
Beer-Lambert est-elle vérifiée pour les solutions contenues dans les
fioles 0 à 4 ? Justifier.
Voir la dernière ligne du tableau : l'absorbance et le
titre sont proportionnels. A = 0,634 t. La loi de Beer-Lambert
est vérifiée.
Déterminer
la concentration massique en ion nitrate de l'eau de ville. Cette eau
est-elle potable ? (la teneur en nitrate doit être
inférieure à 50 mg/L ).
Teneur en nitrate dans la fiole X : t = 0,657 / 0,634 = 1,036 mg / L.
Tenir compte du facteur de dilution au 20ème :
1,036*20 = 20,7 mg/L, valeur inférieure à la norme : cette eau est donc
potable.
Potentiométrie à courant imposé.
On
envisage le titrage des ions nitrate ( dans le becher) par les ions fer
(II) ( dans la burette ) en milieu acide sulfurique. La solution d'ion
fer (II) est une solution de sel de Mohr ( composé de formule FeSO4, (NH4)2SO4, 6H2O
de masse molaire M = 392,13 g/mol, totalement soluble dans le milieu
utilisé pour le titrage ) préparée en dissolvant 5,4702 g de ce
sel dans une fiole jaugée de 200,0 mL dans une solution d'acide
sulfurique à 6 mol/L.
A la prise d'essai de volume V0 =5,00 mL de la solution contenant les ions nitrate à doser, on ajoute 10 mL d'acide sulfurique concentré.
Ecrire l'équation de la réaction de titrage et calculer sa constante d'équilibre à 298 K.
E°(Fe3+aq / Fe2+aq) = 0,77 V ; E°(NO3-aq / NO(g)) =0,96 V.
3Fe2+aq = 3Fe3+aq +3 e- : E1 = E°(Fe3+aq / Fe2+aq) +0,02 log ([Fe3+aq ]3/ [Fe2+aq]3).
NO3-aq +4H+aq= NO(g) + 3e- + 2H2O. E2 =E°(NO3-aq / NO(g)) +0,02 log ([NO3-aq][H+aq]4 / [NO(g)]).
3Fe2+aq +NO3-aq +4H+aq = 3Fe3+aq +NO(g) +2H2O.
K = [Fe3+aq ]3[NO(g)]/ ([NO3-aq][H+aq]4[Fe2+aq]3).
A l'équilibre E1 = E2 : E°(Fe3+aq / Fe2+aq) +0,02 log ([Fe3+aq ]3/ [Fe2+aq]3) = E°(NO3-aq / NO(g)) +0,02 log ([NO3-aq][H+aq]4 / [NO(g)]).
0,02 log ([Fe3+aq ]3/ [Fe2+aq]3) - 0,02 log ([NO3-aq][H+aq]4 / [NO(g)]) = E°(NO3-aq / NO(g)) - E°(Fe3+aq / Fe2+aq).
0,02 log K = E°(NO3-aq / NO(g)) - E°(Fe3+aq / Fe2+aq) = 0,96-0,77 = 0,19 ; log K = 0,19 / 0,02 = 9,5 ; K = 3,2 109.
Déterminer la concentration molaire en ion nitrate de la solution à doser. Volume de la solution de sel de Mohr versé à l'équivalence VE = 4,95 mL.
[Fe2+aq] =5,4702 / (392,13 *0,200) =6,975 10-2 mol/L.
A l'équivalence : 3n(NO3-aq) = n(Fe2+aq) = [Fe2+aq]VE ; 3 [NO3-aq] V0 = [Fe2+aq]VE ;
[NO3-aq] = [Fe2+aq]VE / (3V0 )= 6,975 10-2 *4,95 / 15,00 =2,30 10-2 mol/L.
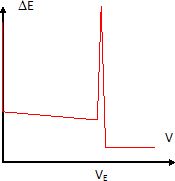
Détermination exprérimentale du volume VE.
La
position relative de chacune des courbes intensté-potentiel sur
électrode de platine est représentée.
Que peut-on dire des systèmes Fe3+/Fe2+ et NO3- / NO sur électode de platine ?
Fe3+/Fe2+ : système rapide ; NO3- / NO : système lent.
Donner
l'allure de la courbe intensité-potentiel sur électrode de platine du
mélange dans le becher pour les volumes versés de la solution d'ion Fe2+ suivants ? Préciser sur chaque vague les espèces qui sont réduites ou oxydées à l'électrode de platine.
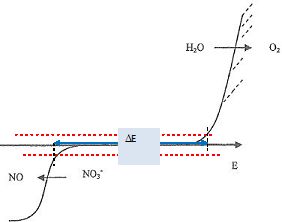
V=0 : les espèces présentes sont : ion nitrate, ion potassium ou sodium, eau.
|
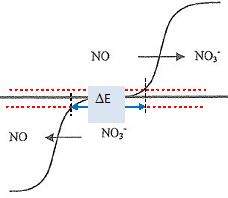
V<VE : les espèces présentes sont : ion nitrate, ion potassium ou sodium, eau, NO et Fe3+.
|
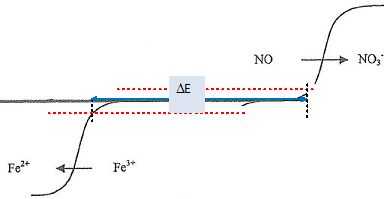
V=VE : les espèces présentes sont : ion potassium ou sodium, eau, NO et Fe3+.
| 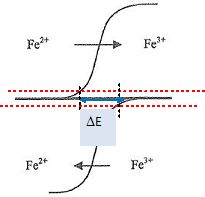
V>VE : les espèces présentes sont : ion fer (II), ion potassium ou sodium, eau, NO et Fe3+.
|
On
introduit deux électrodes de platine dans la solution d'ion nitrate à
doser contenue dans le becher, puis on fait passer entre elles un
courant fixe, non nul mais de très faible intensité. La différence de
potentiel DE entre les deux électrodes est mesurée lors de l'ajout de la solution titrante.
Donner l'allure de la courbe représentant l'évolution de DE en fonction du volume V versé, en précisant la position du volume équivalent.
|
|




