|
|
|
|
La
population microbienne impliquée et son activité respiratoire sont
supposées constantes, ce qui conduit à un nombre constant d'électrons
produits par unité de temps par les bactéries réductrices des composés
azotés. La réduction du dioxygène s'appuyant sur des populations
plus diverses, elle met en jeu un nombre d'électrons disponibles par
unité de temps plus grand que celui qui concerne la réduction des
espèces azotées
La concurence entre les accepteurs d'électrons est caractérisée par
leur concentration respective, ainsi que par leur affinité pour les
électrons. L'effet inhibiteur du dioxygène sur le processus de
dénitrification s'explique par sa très grande affinité pour la
réduction enzymatique : tant que le dioxygène est présent, les
réductions des composés azotés sont trop lentes pour être observées.
Les
équations des réactions de réduction successives mises en oeuvre sont
décrites ci-après, les électrons étant fournis à vitesse constante par
l'activité bactérienne :
O2 +4H++4e- = 2H2O
NO3-+2H++2e- = NO2- + H2O
2NO2- +6H++4e- = N2O +3H2O
N2O +2H++2e- = N2 + H2O
Ces
réductions se font en présence d'enzymes spécifiques à chaque espèce
chimique et on admet les mécanismes suivants pour ces catalyses
enzymatiques :
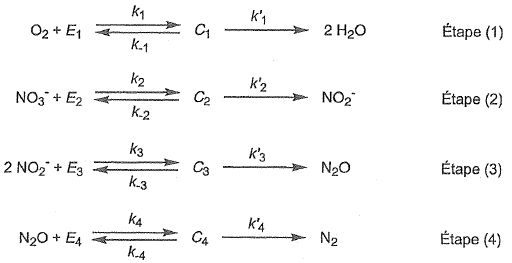
Les Ei ( avec i = 1, 2, 3 ou 4) sont des enzymes spécifiques à chaque espèce chimique et Ci ( avec i =1, 2, 3 ou 4) sont des complexes enzyme-substrat formés respectivement à partir de O2,
NO3-, NO2- et N2O. Les ki, k-i et k'i sont des constantes de vitesse.
Chaque espèce chimique X intervient dans le mécanisme par sa concentration molaire notée [X].
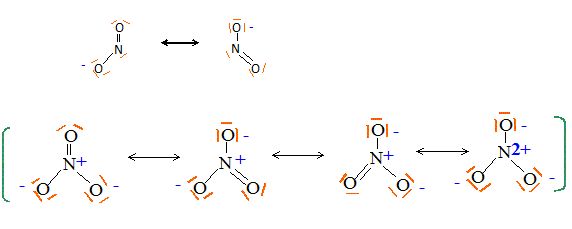
Ecrire les formules de Lewis des ions
NO3-, NO2- et de la molécule N2O.

|
.
Exprimer vdisp(O2), vitesse totale de disparition du dioxygène en fonction des concentrations et constantes de vitesse nécessaires.
L'étape 1 est un équilibre qui s'établit rapidement ; l'étape 2 est lente,
c'est donc elle qui impose la vitesse.
La vitesse de la réaction est égale à : v ~k'1[C1] ; vdisp(O2) ~ k'1[C1].
On admet que l'on peut appliquer l'approximation des états stationnaires aux complexes enzyme-substrat.
Exprimer la concentration du complexe C1 en fonction des concentrations en E1 et en O2 et des constantes de vitesses adéquates.
d[C1]/dt = 0 = k1 [O2][E1]-k-1[C1]-k'1[C1]
[C1] = k1 [O2][E1] / (k-1+k'1). (1).
En utilisant l'équation de conservation de l'enzyme, montrer que : [C1] = [O2][E1]0 / (KM1 +[O2]).
[E1]0 désigne la concentration totale en enzyme sous toutes ses formes et KM1 une constante qu'on exprimera en fonction des constantes de vitesses adéquates.
[E1]0 = [E1] +[C1] ; [E1] = [E1]0 -[C1], repport dans (1).
(k-1+k'1) [C1] = k1 [O2]([E1]0 -[C1]).
(k-1+k'1+ k1 [O2] ) [C1] = k1 [O2][E1]0 ; ((k-1+k'1) / k1 +[O2] ) [C1] = [O2][E1]0 ;
[C1] = [O2][E1]0 / ((k-1+k'1) / k1 +[O2] ). KM1 =(k-1+k'1) / k1.
En déduire l'expression de vdisp(O2).
vdisp(O2) = k'1 [O2][E1]0 / (KM1 +[O2]).
De la même façon, exprimer les vitesses vdisp(NO3-), vdisp(NO2-) et vdisp(N2O), respectivement vitesses de disparition de NO3-, NO2- et de N2O.
On remarquera que des espèces sont formées par une étape et consommées par une autre.
vdisp(NO3-) = v formation (NO2-) = k'2[C2]= k'2 [NO3-][E2]0 / (KM2 +[NO3-]).
vdisp(N2O) = k'4[C4] =k'4 [N2O][E4]0 / (KM4 +[N2O]).
Vitesse de la réaction 3 : v3 = k'3[C3]= k'3 [NO2-][E3]0 / (KM3 +[NO2-]) ; vdisp(NO2-)= 2 v3 - v formation (NO2-).
vdisp(NO2-) =2 k'3 [NO2-][E3]0 / (KM3 +[NO2-])- k'2 [NO3-][E2]0 / (KM2 +[NO3-]).
On
constate expérimentalement que les courbes représentant
l'évolution des concentration des différentes espèces réduites sont
assimilables à des segments de droites.
Quelle approximation peut-on effectuer dans l'expression de la vitesse vdisp(O2) pour rendre compte de ces résultats expérimentaux ?
vdisp(O2) = -d [O2] /dt = constante ; si KM1 << [O2] alors k'1 [O2][E1]0 / (KM1 +[O2])~ k'1 [E1]0.
Dans le cadre de cette approximation, l'enzyme est dite saturée. Que signifie cette affirmation ?
Toutes les molécules d'enzyme sont complexées avec leur substrat spécifique. La vitesse maximale est atteinte.
Il a été constaté expérimentalement que le dioxygène inhibe la
réduction des ions nitrate et que les ions nitrate et nitrite
inhibent celle de l'oxyde nitreux. En d'autres termes, la
réduction des ions nitrate ne commence que lorsque le dioxygène a
disparu presque totalement et la réduction de N2O ne
commence que lorsqu'il n'y a pratiquement plus d'ions nitrate ni
d'ions nitrite. Par ailleurs la concentration en ion nitrite reste très
faible et très inférieure aux autres concentration pendant tout le
processus de dénitrification.
Les conditions sont telles que la production d'électrons par les
bactéries est le facteur limitant des réductions des composés azotés.
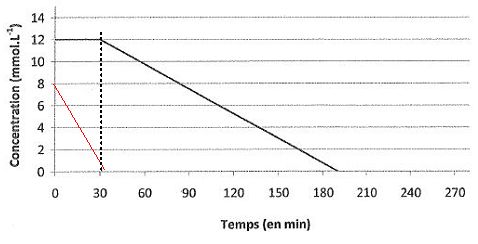
Pour des concentrations initiales e [O2]0 = 8,0 mmol/L et [NO3-]0
= 12,0 mmol/L, on donne ci-dessous la courbe représentative de
l'évolution de la concentration en ion nitrate en fonction du temps.
Tracer
sur le graphe la courbe donnant l'évolution de la concentration en
dioxygène en fonction du temps dans les conditions mentionnées ci-dessus. ( voir courbe rouge ).
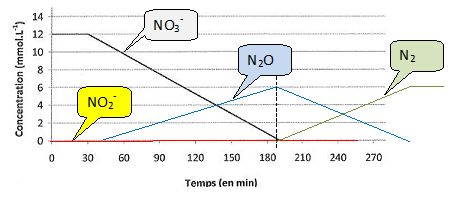
Dans l'hypothèse d'un débit constant en électrons produits par les
bactéries réductrices des espèces azotées, en tenant compte du nombre
d'électrons échangés lors des réductions successives des composés
azotés, tracer sur le même graphe les autres courbes représentant les évolutions temporelles des concentrations [NO2-], [N2O] et [N2].
Les valeurs absolues despentes des segments de droite sont proportionnelles aux nombre d'électrons échangés.
|
.
|




