|
|
Structure de la matière.
Donner
la structure électronique de l'élément chlore.
( Z = 17 ).
1s2 2s2 2p6
3s2 3p5.
Dans
quelle colonne et sur quelle ligne du tableau périodique se trouve
l'élément chlore ?
Colonne 17
( famille des halogènes) ; 3è ligne ou période.
Représenter
le schéma de Lewis de la molécule de dichlore.
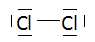
Préparation
du dichlore par électrolyse d'une eau salée.
l'électrolyse
d'une solution de chlorure de sodium permet de produire du dichlore qui
se dissout dans l'eau pour donner de l'acide hypochloreux HClO.
Indiquer
les espèces chimiques présentes dans l'eau salée.
H2O, ion chlorure Cl-aq,
ion sodium Na+aq, HClO aq , ClO-aq
, H+aq et HO- aq.
Ecrire
toutes les demi-équations d'oxydoréduction possibles à la cathode.
Pour simplifier on considèrera le milieu comme acide.
Réduction à la cathode négative : 2H+aq + 2e-
= H2(g) ; Na+aq
+ e- = Na(s).
2HClO aq + 2e-
+ 2H+aq = Cl2(g)
+ 2H2O
; 2HClO aq + 4e-
+ 2H+aq = 2Cl-aq + 2H2O.
Ecrire
toutes les demi-équations d'oxydoréduction possibles à l'anode.
Pour simplifier on considèrera le milieu comme acide.
Oxydation à l'anode positive : 2Cl-aq = Cl2(g)
+ 2e- ; H2O = ½O2(g)
+ 2e- + 2H+aq.
Du point de vue thermodynamique, en l'absence de surtension au niveau
des électrodes, écrire
l'équation de la réaction du bilan de l'électrolyse.
E°( H+aq
/ H2(g)) = 0 ; E°( Na+aq / Na(s)) = -2,71
V ; E°( Cl2(g) / Cl-aq) = 1,39 V
; E°( O2(g) / H2Oaq) = 1,23 V
;
E°(HClOaq / Cl2(g))
= 1,59 V ; E°(HClOaq
/ Cl-aq) = 1,49
V.
H2Oaq
---> H2(g)
+ ½ O2(g)
.
La tension minimale d'électrolyse étant E0 = E°( O2(g) / H2Oaq) -E°( H+aq
/ H2(g)) = 1,23-0
= 1,23 V.
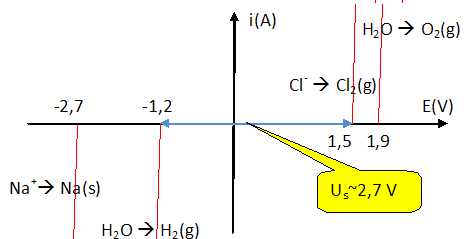
On donne les courbes intensité-potentiel pour une eau salée de
concentration c = 4 g / L.
Les
vitesses de réactions sont-elles plus élevées pour un courant
d'électrolyse de 1 A ou de 4 A ? Justifier.
La cinétique de la réaction est d'autant plus élevée que
l'intensité du courant augmente.
Déterminer
la tension minimale Us
d'électrolyse de l'eau salée.
Pour une intensité très faible, les courbes donnent Us
~2,7 V.
En pratique,l'électrolyseur est traversé par un courant d'intensité I =
4 A.
Déterminer
le potentiel de l'anode Ea et celui
de la cathode Ec.
Ea
~1,5 V ; Ec
~ -1,2 V.
En
déduire l'équation bilan de l'électrolyse en milieu acide pour
simplifier.
2Cl-aq
= Cl2(g) + 2e- ; 2H+aq
+ 2e- = H2(g) ; 2Cl-aq
+ 2H+aq
= Cl2(g)
+ H2(g).
|
| .
. |
.
|
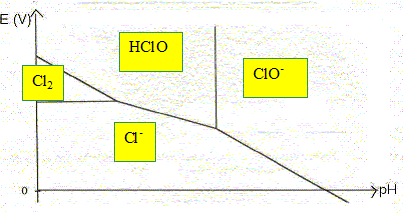
Diagramme
potentiel-pH du chlore.
Le diagramme est représenté pour une concentration en chlore de 0,10
mol/L. Les espèces du chlore en solution aqueuse considérées pour la
construction de ce diagramme sont Cl2aq, Cl-aq,
HClOaq et ClO-aq. La courbe en pointillé
représente la droite frontière du couple O2(g) /
H2O.
Donner
le nombre d'oxydation du chlore dans les 4 espèces citées.
Cl2aq : n.o(Cl) =0 ; Cl-aq
: n.o(Cl) = -I ; HClOaq et ClO-aq : n.o(Cl) = +I.
Indiquer
les domaines de prédominances des 4 espèces du chlore.
Ecrire
la demi-équation d'oxydo-réduction du couple O2(g) / H2O puis
écrire l'équation de la droite frontière séparant les domaines O2(g) et H2O pour une
pression en dioxygène de 1 bar.
H2O
= ½O2(g) + 2e- + 2H+aq.
E4 = E°(O2(g) / H2O)
+ 0,03 log [H+aq]2
P½O2 = 1,23 -0,06 pH.
Lorsqu'on fait barboter du dichlore gazeux dans l'eau, on observe
l'équilibre Cl2(g) = Cl2(aq).
Dans
quelle zone de pH faut-il se placer pour dissoudre davantage de
dichlore dans l'eau ?
Entre pH 0 et pH = 2.
Donner la
( ou les) espèce(s) du chlore obtenue(s) par dissolution du dichlore
àpH= 4 et pH = 10.
A
pH= 4 : HClO et Cl- ; à pH = 10
: ClO- et Cl-.
Sous
quelle(s) forme(s) l'élément chlore est-il stable dans l'eau ?
Le dichlore se dismute en ion chlorure et ion hypochlorite ( ou en
acide hypochloreux ).
L'équation de la réaction associée à la formation de l'eau de chlore
s'écrit :
Cl2 aq + 2H2O = HClOaq +
Cl-aq + H3O+aq
(1).
Donner
l'expression de la constante d'équilibre K liée à l'équation précédente.
K = [HClOaq][Cl-aq] [H3O+aq]
/ [Cl2aq].
Ecrire
la demi-équation d'oxydoréduction du couple HClO / Cl2 aq puis
donner l'expression littérale du potentiel d'électrode E1 de ce
couple.
2HClO aq + 2e-
+ 2H+aq = Cl2(aq)
+ 2H2O.
E1 = E°( Cl2(aq)
/HClO aq ) +0,03
log ([Cl2aq]
/ ( HClOaq]2[H3O+aq]2)).
Donner
l'expression littérale du potentiel d'électrode E2 du couple Cl2(g) / Cl-aq
.
2Cl-aq
= Cl2(g) + 2e- ; E2
= E°( Cl2(g) / Cl-aq ) +0,03
log ( [Cl2aq]
/ [Cl-aq ]2).
En
déduire la valeur de K.
A l'équilibre E1 = E2 : E°( HClO aq / Cl2(aq) ) +0,03 log
(
HClOaq]2[H3O+aq]2/
[Cl2aq] )
=
E°( Cl2(g) / Cl-aq ) +0,03
log ( [Cl2aq]
/ [Cl-aq ]2).
E°( HClO aq / Cl2(aq)
) -
E°( Cl2(g) / Cl-aq )
= 0,03
log (
HClOaq]2[H3O+aq]2/
[Cl2aq] )-0,03 log (
[Cl2aq]
/ [Cl-aq ]2).
E°( HClO aq / Cl2(aq) ) -
E°( Cl2(g) / Cl-aq )
= 0,03 log
([HClOaq]2
[Cl-aq ]2[H3O+aq]2/
[Cl2
aq]2)=0,03 log K2
= 0,06 log K.
1,59-1,39 = 0,06 log K : log K = 0,20 / 0,06 =3,3 ; K ~ 2,2 103.
|
Ordre
de réaction.
En solution alcaline, l'ion hypochlorite se dismute suivant : 3 ClO-
aq ---> ClO3-aq +
2Cl-aq. On pose C = [ClO- aq] en mol/L.
Une étude expérimentale a permis de tracer les courbes suivantes :
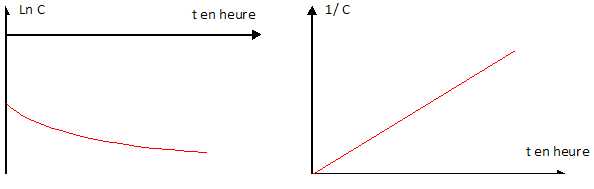
L'ordre n
de réaction par rapport aux ions hypochlorite est-il égal à 0, 1 ou 2 ?
Justifier.
v
= dC/dt = -k Cn ; dC /Cn =
-kdt.
Si n= 0
: dC = -k dt et C = -kt + constante ; la courbe C = f(t) est une droite.
Si n = 1
: dC / C = -kdt ; d ln C = -kdt ; ln C = -kt + constante ; la courbe ln
C = f(t) est une droite.
Si n=2
: dC /C2 =
-kdt ; -d(1/C) = - kdt ; 1/C = kt + constante ; la courbe 1/C =f(t) est
une droite. Donc n = 2.
Quelle
est l'unité de k ? C s'exprime en mol L-1
et la vitesse s'exprime en mol L-1 h-1.
k a la dimension de 1 / ( C t ) ; k s'exprime donc en
L mol-1 h-1.
De
quel paramètre k dépend-elle ?
k dépend de la température.
Chimie organique.
Le benzène peur réagir avec le chlore de deux façons différentes : par addition ou par substitution.
Ecrire l'équation d'addition lorsque le dichlore est en excès et donner le nom du produit obtenu.
C6H6+3Cl2 ---> C6H6Cl6 ; 1, 2, 3, 4, 5 ,6- hexachlorocyclohexane.
Ecrire
l'équation de monosubstitution d'une mole de dichlore en présence de
chlorure d'aluminium III et donner le nom du produit obtenu.
C6H6+Cl2 ---> C6H5Cl + HCl ; monochlorobenzène.
L'acide
hypochloreux peut agir comme agent aseptisant lors du traitement des
eaux de piscines. Il agit par substitution sur l'éthanamine.
Donner la formule semi-développée de l'éthanamine. CH3 - CH2 - NH2.
Ecrire la réaction entre l'éthanamine et l'acide hypochloreux.
CH3 - CH2 - NH2 + HClO ---> CH3 - CH2 - NHCl + H2O.
CH3 - CH2 - NHCl ++ HClO ---> CH3 - CH2 - NCl2 + H2O.
Les dérivés chlorés des alcanes sont toxiques.
Ecrire la formule semi-développée du 1,2-dichlorométhylpropane et proposer la formule d'un de ses isomères.
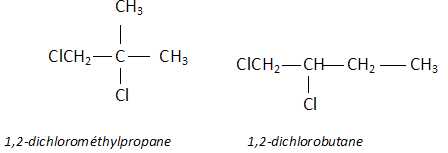 |
|