|
|
L'iode 131 permet le suivi des cancers thyroïdiens. Il est radioactif ß- et a un temps de demi-vie t½ = 8 j.
Un nucléide peut être représenté par la notation AZX.
Donner la signification des différents éléments.
A : nombre de nucléons ou nombre de masse
Z : n° atomique ou nombre de charge ou nombre de protons
X : symbole de l'élément chimique.
Parmi les 37 isotopes que compte l'iode, un seul, l'iode 127, est stable.
Définir l'expression " isotopes d'un élément ".
Des isotopes ne diffèrent que par leur nombre de neutrons. Ils possèdent le même numéro atomique Z.
Donner la composition du noyau d'un atome d'iode 127. Z = 53.
53 protons et 127-53 =74 neutrons.
Que signifie l'expression "l'iode 131 est radioactif ß-" ?
Lors de sa désintégration l'iode 131 émet un électron 0-1e.
Ecrire l'équation de désintégration de l'iode 131.
13153I ---> AZX + 0-1e.
Conservation de la charge : 53 = Z-1 d'où Z = 54 ( élément Xe ).
Conservation du nombre de nucléons : 131 = A +0 d'où A = 131.
13153I ---> 13154Xe + 0-1e.
Définir le temps de demi-vie.
Le temps de demi-vie est la durée au bout de laquelle l'activité initiale est divisée par deux.
Lors d'un examen, un malade ingère une dose d'iode 131 de masse égale à 3,0 10-8 g sous forme d'une gélule d'iodure de sodium. La dose injectée est en général comprise entre 111 et 185 MBq.
Vérifier que 1,4 1014 noyaux d'iode 131 sont présents dans l'échantillon.
NA = 6,02 1023 mol-1 ; M(131I) = 131 g/mol.
N = m/ M NA = 3,0 10-8 / 131 *6,02 1023~1,4 1014 noyaux.
En déduire l'activité A0 de cette gélule. Est-elle conforme à la norme ? l = 1,0 10-6 s-1.
A0 = l N = 1,0 10-6 *1,4 1014 =1,4 108 Bq = 1,4 102 MBq.
Cette valeur étant comprise entre 111 et 185 MBq, la gélule est conforme à la norme.
Montrer que l'activité de la gélule sera égale à 1 % de son activité initiale au bout de 53 jours.
Loi de décroissance radioactive : A = A0 exp(-lt) ; A / A0 = 0,01 = exp(-lt) ; ln 0,01 = -4,6 = -lt.
t = 4,6 / (1,0 10-6) =4,6 106 s ou 4,6 106 /(3600*24) ~53 jours.
Le temps de demi-vie de l'iode 131 est de 8 jours, celui de l'iode 127 est de 13,2 heures.
Justifier,
sans calculs, le fait que, depuis quelques années, on utilise cet
isotope de l'iode, plutôt que l'iode 131, en imagerie médicale.
L'activité de l'iode 127 est quasiment nulle au bout de 4 ou 5 jours.
|
| .
. |
.
|
Détermination indirecte du taux de thyroxyne libre.
La
régulation de la production d'hormones thyroïdiennes se fait par une
hormone secrétée par l'antéhypophyse, la thyréostimuline ou TSH. En
dosant la TSH, il est possible de déterminer de manière indirecte le
taux de thyroxine libre. La technique utilisée est celle de la
spectrofluorimétrie. Pour réaliser ce type de mesure, on forme un
complexe en intégrant la TSH entre deux anticorps dont l'un est
fluorescent.
Pour simplifier, on supposera que le complexe présente un diagramme énergétique identique à celui d'un atome.
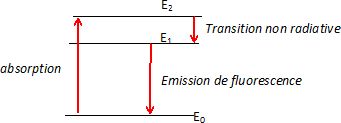
On envoie radiation dont la longueur d'onde fait passer le complexe de l'état de plus basse énergie E0 à l'état excité d'énergie E2.
La fluorescence s'explique par le fait qu'une transition non radiative
( c'est à dire n'émettant pas de photon ) le ramène dans un état
intermédiaire d'énergie E1. La fluorescence s'observe ensuite lorsque le complexe passe du niveau E1 au niveau E0.
|
Comment s'appelle le niveau d'énergie E0 ?
Le niveau fondamental est le niveau de plus basse énergie.
Donner en fonction des énergies E2 et E0, l'expression de la fréquence de la radiation d'excitation absorbée.
n1 = (E2-E0) / h avec h la constante de Planck.
Donner en fonction des énergies E1 et E0, l'expression de la fréquence de la radiation d'excitation absorbée.
n2 = (E1-E0) / h.
Que
penser de l'affirmation " le spectre de fluorescence est décalée vers
les grandes longueurs d'onde par rapport à celui de l'absorption" ?
l1 = hc / (E2-E0) ; l2 = hc / (E1-E0) ; or (E2-E0) > (E1-E0), donc l2 > l1. L'affirmation est vraie. |
|