La technologie
micro-ondes au service de la chimie verte : bac STL 2013.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
...
|
|
|
|
|
Parmi
les 12 critères de base définissant la "chimie verte" (green
chemistry), énoncés en 1998 par deux chimistes, Paul Anastas et John C.
Warner, on trouve :
- produire moins de déchets plutôt qu'investir dans l'assainissement ou l'élimination des déchets ;
- lorsque c'est possible, supprimer l'utilisation de substances
auxiliaires (solvants, agents de séparation...) ou utiliser des
substances inoffensives (utilisation de l'eau comme solvant,
utilisation de fluides supercritiques, de liquides ioniques) ;
- économiser l’énergie.
Des méthodes non conventionnelles d'activation peuvent être utilisées :
chauffage par micro-ondes, réaction par voie photochimique,
sonochimique, etc.
La chimie sous micro-ondes est une technique de plus en plus utilisée
dans les laboratoires et dans l’industrie car elle répond aux critères
de la chimie verte. A la fois simple à mettre en oeuvre, rapide et
sélective, elle présente de nombreux intérêts et permet de synthétiser
de nombreux composés.
Les réactions mises en oeuvre industriellement sont plus ou moins
longues et complexes. On choisit d’étudier la réaction d’estérification.
Comment fonctionne le four à micro-ondes ?
A quoi est dû l’échauffement des produits dans le four à micro-ondes ?
L'échauffement des produits est dû à l'agitation des molécules d’eau contenues dans le produit à chauffer.
« Sous l’action des micro-ondes, les molécules d’eau vont se
mettre à changer d’orientation à la même fréquence de 2 450 000 000
fois par seconde. La mise en mouvement des molécules d’eau va produire
de la chaleur qui va chauffer ou cuire les aliments. » « Les fours à
micro-ondes utilisent tous la même fréquence de 2,45 GHz. »
Quelles informations liées à la définition d’une fréquence permettent de retrouver cette valeur ?
« les molécules d’eau vont se mettre à changer d’orientation […] 2 450 000 000 fois par seconde ».
f =2 450 000 000 = 2,45 x 10 9 = 2,45 GHz.
Vérifier, par le calcul, qu’il s’agit bien de micro-ondes.
l = c / f = 3,0 108 / (2,45 x 109) = 0,12 m.
Les micro-ondes ont des longueurs d’ondes comprises entre 1 mm et 1m.
Quel argument justifie l’utilisation par les industriels de cette fréquence ?
Ce type d'ondes « peut être utilisé sans demande d'autorisation auprès des autorités »
|
|
|
On
tolère un certain niveau de fuite pour les micro-ondes générées par le
four. Il existe des normes concernant le niveau de « fuite » des fours.
Ces fuites sont mesurées par un capteur de surface S égale à 12 cm2 = 1,2 x10-3 m2, fournissant des résultats exprimés en dBm.
Les relations entre la puissance exprimée en mW notée PmW et la puissance exprimée en dBm notée PdBm sont :
PdBm = 10 × log(PmW) et PdBm = 10PmW / 10.
La densité de puissance est donnée par le rapport P / S.
Ainsi une puissance de P = 1,0 mW, répartie sur une surface de 12 cm2, correspond à une densité de puissance de 1,0 x 10-3 / (12 x 10-4) =0,85 W m-2 ou 8,5 x 102 mW/m2.
Compléter le tableau suivant correspondant à des mesures effectuées sur un four correctement isolé contenant un objet à chauffer :
Distance (cm)
|
20
|
40
|
100
|
Puissance (dBm)
|
10 log 0,204 = -6,9
|
-15
|
-20
|
Puissance ( mW)
|
1,7 102*12 x 10-4
=0,204 ~0,20 mW
|
3,2 10-2
|
10-2
|
Densité de puisance ( mW m-2)
|
1,7 102
|
3,2 10-2 / (12 10-4)
=26,7 ~27
|
10-2 /(12 10-4)
= 8,3
|
Si le four fonctionne lorsqu’il est vide, la densité de puissance, à 20 cm de la porte, peut atteindre 2,7 W/m². Comparer cette valeur à celle d’un four contenant un objet.
Cette valeur est environ 2,7/0,17 ~16 fois plus grande que lorsque le four contient un objet.
Citer deux précautions d’usage à indiquer sur une notice d’utilisation d’un four à micro-ondes.
Le four ne doit pas être utilisé à vide ;
Eviter les fuites en fermant correctement la porte.
|
.
|
|
Estérification aux micro-ondes, quels avantages ?
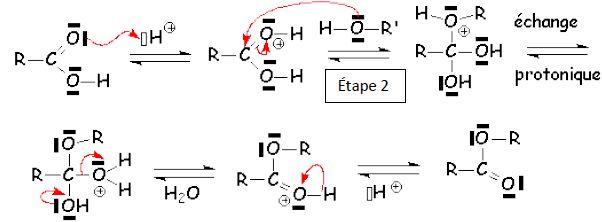
Expliquer le mécanisme réactionnel de l’étape n°2 en précisant la nature des sites concernés et le type de réaction.
L'atome
d'oxygène de l'alcool R' OH est donneur d'électron ( site nucléophile
). L'atome de carbone du groupe carboxyle est appauvri en électron (
site électrophile ). Il en résulte une addition nucléophile sur cet
atome de carbone.
Préciser le rôle de l’acide sulfurique concentré utilisé lors de la réaction.
L'acide
sullfurique joue le rôle de catalyseur : il protone l'oxygène du groupe
C=O, ce qui rend plus électrophile le carbone de ce même groupe. Il est
régénéré lors de la dernière étape.
Travail d’analyse et d’argumentation.
Préparation classique : le chauffage à reflux.
Introduire dans le ballon : 15 mL de 3-méthylbutan-1-ol à 98 %
correspondant à 0,14 mol ; 20 mL d'acide éthanoïque à 99 %
correspondant à 0,35 mol. ; quelques grains de pierre ponce ou quelques
billes de verre ; 1 mL d’acide sulfurique concentré.
Adapter le réfrigérant et porter le mélange à l'ébullition douce à
120°C pendant 45 min. Après le chauffage à reflux, les réactifs et les
produits restent dans le milieu réactionnel.
Procéder alors à une extraction liquide-liquide, filtrer puis sécher
pour récupérer l’ester. À la fin de la synthèse, on obtient ainsi un
volume d’ester V (ester) = 15,5 mL.
Remarque : pour un mélange équimolaire d'acide carboxylique et d’alcool primaire, le rendement est de 67 %.
Concernant la synthèse par chauffage à reflux.Un réactif a été introduit en excès. Lequel ? Justifier.
Une mole d'acide carboxylique réagit avec une mole d'alcool ; 0,14 mol
d'alcool réagit avec 0,14 mol d'acide éthanoïque ; ce dernier est en
excès de 0,35-0,14 = 0,21 mol.
Calculer le rendement R1 de la réaction d’estérification. Le comparer à celui obtenu à partir d’un mélange équimolaire. Conclure.
rester = 0,87 g/mL ; M(ester) = 130 g/mol.
Quantité théorique d'ester ( cas d'une réaction totale ) : 0,14 mol.
Quantité d'ester expérimentale : V(ester) rester / M(ester) = 15,5*0,87 / 130 = 0,104 mol ; R1 = 0,104 / 0,14 = 0,74 ( 74 %).
En utilisant un réactif en excès, on augmente le rendement ( par rapport au mélange éduimolaire ).
Autre voie de préparation : le micro-onde.
Introduire dans un récipient adapté : 15 mL de 3-méthylbutan-1-ol à 98
% correspondant à 0,14 mol ; 8 mL d'acide éthanoïque à 99 %
correspondant à 0,14 mol ; 1 mL d’acide sulfurique concentré.
Placer le récipient sur le bord du plateau tournant de sorte qu’il soit
agité en permanence. Sur la position de puissance maximale (1000 W), la
température du milieu réactionnel atteint 180°C.
Le temps d’irradiation est fractionné en courtes périodes afin de limiter l’évaporation des réactifs et de l’ester.
Sortir le récipient avec des gants adaptés et laisser refroidir le mélange. Une forte odeur de banane devrait se dégager.
Procéder alors à une extraction liquide-liquide, filtrer puis sécher pour récupérer l’ester.
A la fin de la synthèse, on obtient ainsi un volume d’ester V (ester) = 19,5 mL correspondant à un rendement de 93%.
La synthèse assistée par micro-ondes est la meilleure voie pour les
laboratoires de recherches car elle permet d’effectuer en quelques
secondes (refroidissement inclus) des synthèses pouvant durer plusieurs
heures dans un système de chauffage conventionnel. En effet, chaque
réaction chimique est régie par une cinétique. Plus la température de
la synthèse est élevée, plus la synthèse s’effectue rapidement. On
montre qu’une augmentation de dix degrés permet de diviser par deux le
temps de réaction. Ainsi, le gain de temps peut alors être
considérable. La contrainte limitant cette possibilité reste toutefois
les températures d’ébullition des espèces chimiques concernées. Parmi
les techniques utilisées dans les laboratoires de synthèse, on retrouve
le four à micro-ondes de synthèse.
Caractéristiques : chauffage et refroidissement très rapides (10°C par
seconde) ; plusieurs synthèses en simultané possibles, grande
répétabilité.
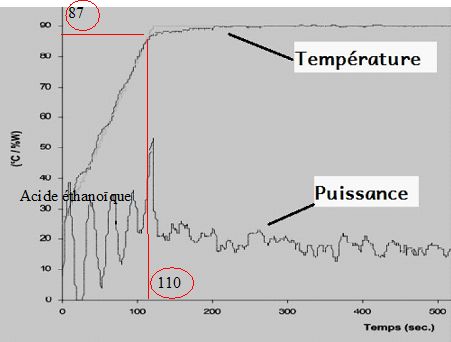
Quel est l’écart entre les températures de réaction des deux protocoles ?
Dns le montage à reflux, la température du milieu réactionnel atteint
120 °C ; dans le micro-onde cette température atteint 180°C, soit
60°C de plus.
En déduire que le temps de réaction dans le four micro-ondes est égal à 42 s.
Dans le dispositif avec chauffage à reflux, le temps de réaction vaut 45 minutes.
Une augmentation de dix degrés permet de diviser par deux le temps de
réaction. Une augmentation de température de 60 °C permet de diviser
par 26 = 64 le temps de réaction : 45/64 = 0,70 min ou 42 s.
Les rendements obtenus lors de plusieurs essais de cette synthèse sont rassemblés dans le tableau ci-dessous :
Essai
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
Rendement R2 %
|
95
|
87
|
92
|
89
|
90
|
93
|
92
|
97
|
94
|
91
|
On rappelle différents éléments permettant de calculer l’incertitude sur la détermination du rendement.
Résultat pour une grandeur G : G = g ± UG avec g la valeur moyenne de G et UG son incertitude.
Calcul de l’incertitude UG = t % σ n½ .
Valeur moyenne du rendement : R2 = 92% ; t% : coefficient de
Student pour 10 mesures et un intervalle de confiance de 95% : t% = 2,3
; σ = 2,9 ; n : nombre d’essais.
Calculer à partir de ces données l’incertitude UG sur le rendement R2 pour un intervalle de confiance de 95 %. Présenter votre résultat sous la forme d’un encadrement.
uG = 2,3*2,9 / 10½ =2,1 % ; G = (92 ±2,1)%. 89,9 < R2 < 94,1 %.
|
Consommation d’énergie.
Calculer l’énergie consommée lors du chauffage à reflux sachant que la puissance électrique du chauffe-ballon est 250 W.
Energie ( J) = puissance (W) fois durée du chauffage (s) =250*45*60 ~6,8 105 J.
Calculer l’énergie consommée lors du chauffage par micro-ondes sachant que la puissance électrique du four est 1000 W.
Energie ( J) = puissance (W) fois durée du chauffage (s) =1000*42 ~4,2 104 J.
En quoi la technologie micro-ondes répond-elle à certains critères de la chimie verte ?
Produire moins de déchets plutôt qu'investir dans l'assainissement ou
l'élimination des déchets : en partant d'un mélange équimolaire, le
rendement de la réaction avec four à micro-onde est très supérieur à
celui de la réaction avec montage à reflux. De plus il n'est pas
nécessaire d'utiliser un réactif en excès.
La synthèse par micro-ondes, permet d’économiser l’énergie.
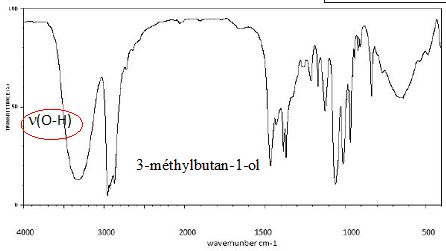
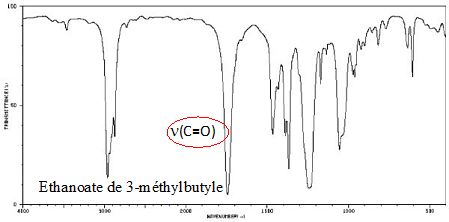
Etude des spectres infrarouges des réactifs et produits.
Identifier
les spectres IR du 3-méthylbutan-1-ol, de l'acide éthanoïque et de
l'éthanoate de 3-méthylbutyle. Entourer la ou les vibration(s) ayant
permis l’identification de la molécule et donner le nom de la
liaison correspondante.
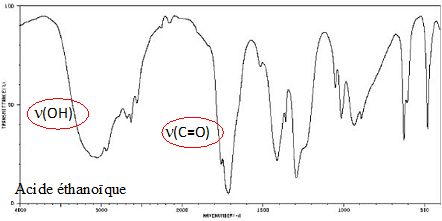
|
|