.
|
Un nouveau-né boit
quotidiennement un volume de lait noté V égal à 700 mL. La
concentration molaire de la carnitine dans le lait C est égale à 8,0 x
10-5 mol.L-1.
Montrer
que la quantité de matière n de carnitine absorbée par le nourrisson
quotidiennement est égale à 5,6 x 10-5 mol.
n = CV = 0,700 *8,0 10-5 =5,6 10-5 mol.
Déterminer
la masse de carnitine absorbée par le nouveau-né.
Donnée : Masse molaire de la carnitine : M = 161 g.mol-1.
m = n M = 5,6 10-5*161 =9,0 10-3 g = 9,0 mg.
Cette masse est très faible, quelques milligrammes. Peut-on pour autant
se passer de cette espèce chimique ? Justifier la réponse.
Non, cette espèce est indispensable : elle
contribue au transport des acides gras à l’intérieur de la mitochondrie.
Dans
le texte introductif, il est mentionné que la carnitine contribue au
transport des acides gras vers les mitochondries où ils sont oxydés.
Lors
d’une oxydation, il y a : Indiquer la ou les
bonne(s) réponse(s).
a)
gain d’électrons. Faux.
b) perte d’électrons. Vrai.
c) gain de protons H+.Faux. d) perte de protons H+.
Faux.
Le lait maternel peut être
remplacé par des laits maternisés en poudre auxquels on ajoute une eau
minérale adaptée.
L’étiquette de cette eau minérale est représentée ci-dessous. On se
propose dans cet exercice de vérifier expérimentalement sa teneur en
ions hydrogénocarbonate HCO3-. L’ion
hydrogénocarbonate est la base du couple acide/base (CO2, H2O)
/ HCO3-.
Définir une base
selon Brönsted.
Une base est une espèce, ion ou molécule, susceptible de gagner un
proton H+.
Le pKa du couple (CO2,
H2O) / HCO3-
est égal à 6,3.
Tracer
le diagramme de prédominance des espèces.
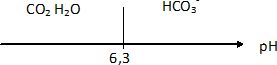
Le pH de l'eau est égal à 7,2.
Quelle
est l'espèce chimique prédominante ? Justifier.
A pH supérieur au pKa, la forme HCO3-
prédomine.
On dose un volume Vb=50,0 mL d'eau minérale par une solution
d'acide chlorhydrique de concentration Ca = 2,0 10-2
mol/L.
Choisir
le bon dispositif de dosage.
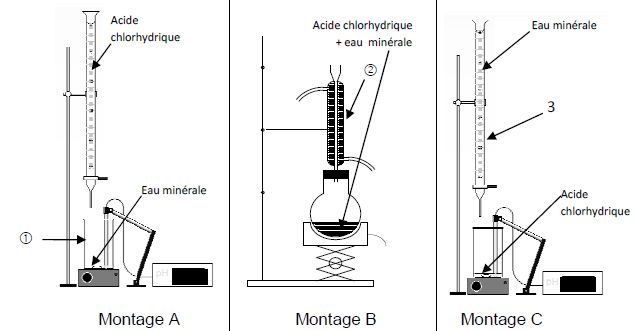
Le montage A est correct, l'espèce à doser est dans le becher, la
solution titrante est dans la burette graduée.
Nommer
les éléments 1, 2 et 3.
1 : becher ; 2 : réfrigérant à eau ; 3 : burette graduée.
Déterminer
graphiquement le point équivalent noté E.
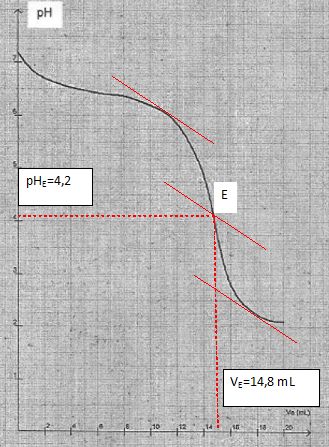
|
La
réaction support du titrage est HCO3- + H3O+
---> CO2 + 2H2O.
Définir
l’équivalence.
A l'équivalence les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'un des réactifs
est en excès, après l'équivalence, l'autre réactif est en excès.
Donner
la relation entre la quantité de matière nb d'ion
hydrogénocarbonate dosé et la quantité de matière naE d'ion oxonium
apportée à l'équivalence.
nb
=naE.
A
l'équivalence Ca VaE = CbVb
et on admet que VaE = 14,6 mL.
Vérifier
que Cb = 5,8 10-3 mol/L.
Cb
= Ca
VaE /Vb
=2,0 10-2*14,6 / 50,0 = 5,8 10-3 mol/L.
Calculer
la concentration massique en ion hydrogénocarbonate. M(HCO3-)
= 61 g/mol.
mmassique = Cb
M(HCO3-) = 5,8
10-3*61
=0,356 ~0,36 g/L ou 3,6 102 mg/L.
Cette valeur est en accord avec les indications de l'étiquette ( 360
mg/L ).
|
|