Edulcorants, acides a-aminés, peptide, aspirine,
bac
St2S 09/2013.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
Lors d’un vol, des boissons et des repas
sont servis aux passagers. Des sodas allégés sont proposés. Ces
boissons peuvent contenir deux types d’édulcorants : l’aspartame et
l’extrait de stévia.
La stévia ou chanvre d’eau est une plante dont sont extraits des
édulcorants intenses. L'Autorité européenne de sécurité des aliments
émet le 14 avril 2010 un avis favorable pour l’utilisation de
différents extraits purifiés de stévia, et en fixe une dose journalière
admissible de 4 mg/kg de masse corporelle. Cela correspond à la DJA
précédemment établie par le JECFA, Comité international mixte d'experts
sur les additifs alimentaires FAO/OMS12.
http://www.efsa.europa.eu/fr/topics/topic/additives.htm
http://fr.wikipedia.org/wiki/Stevia
Donner
la définition de la dose journalière admissible (DJA).
Masse maximale que l'on peut consommer par jour sans risque
pour la santé.
A
l'aide du texte ci-dessus, retrouver la valeur de la DJA pour l'extrait
de stévia puis calculer la masse maximale de cet extrait qu'un adulte
de 75 kg peut consommer quotidiennement.
Dose journalière admissible : 4
mg/kg.
Masse maximale consommable chaque jour par un individu de masse
75 kg : 4*75 =3,0 102 mg ou 0,30 g.
Un litre d’une boisson édulcorée contient
0,60 gramme d’extrait de stévia.
Montrer
que le volume maximal de cette boisson que peut consommer
quotidiennement un adulte de 75 kg est égal à 0,5 L.
0,60 / 0,30 = 0,5 L.
Commenter
le résultat précédent.
Un adulte boit en général deux litres d'eau ou de sodas par jour : il
est donc facile de dépasser la DJA de stévia.
Structure
des édulcorants.
Nommer
les groupes caractéristiques encadrés sur les formules semi-développées
suivantes.
Encadrer,
sur la formule semi-développée de l'aspartame fournie la liaison
peptidique.
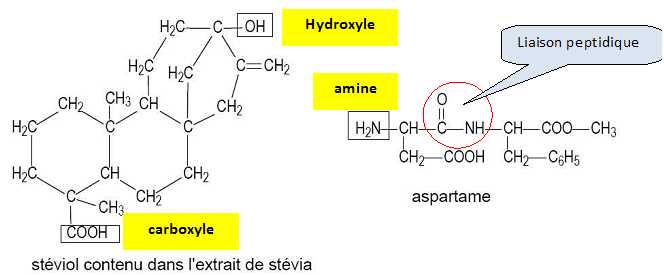
La liaison peptidique est un cas particulier d'un groupe
caractéristique. Nommer ce
groupe.
Groupe amide.
|
|
|
Lors de la digestion, l’aspartame subit une
hydrolyse et libère trois espèces chimiques. L’équation de la réaction
est la suivante :
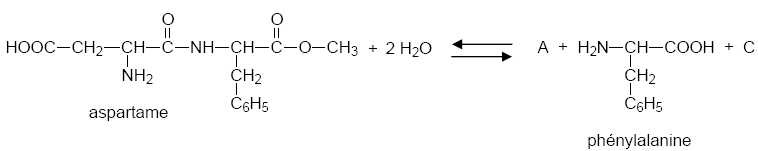
Choisir et
nommer le montage qui permet de réaliser cette hydrolyse en laboratoire.
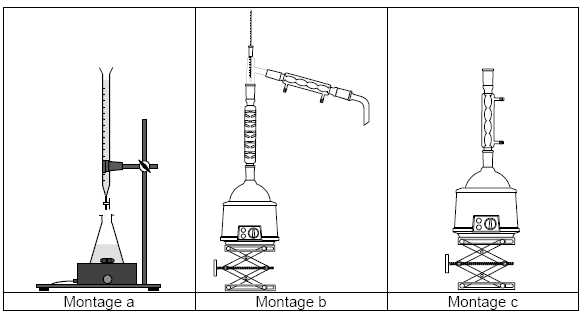
Chauffage à reflux : montage c.
Identifier
dans la liste ci-dessous, la molécule A et recopier sa formule sur la
copie.
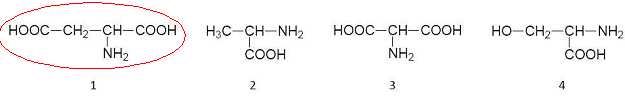 . .
|
.
A
son arrivée, un passager est affecté par un mal de tête. Un ami lui
donne un comprimé d’aspirine.
La formule semi-développée de l’aspirine est la suivante :
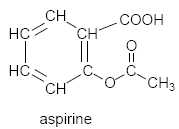
Dans la suite de l’exercice, l’aspirine, qui est un acide carboxylique
faible, sera représentée par la formule simplifiée R-COOH.
Ecrire
l’équation de la réaction de l'aspirine avec l'eau.
R-COOH aq + H2O = RCOO-aq
+ H3O+aq.
Donner
l’expression de la constante d’acidité Ka de
l’aspirine.
Ka = [RCOO-aq][H3O+aq]
/ [R-COOH
aq].
Le couple acide/base dont fait partie l’aspirine a un pKa
égal à 3,5.
Calculer
la valeur de la constante d’acidité Ka.
Ka = 10-pKa = 10-3,5
=3,2 10-4.
Représenter
le diagramme de prédominance des espèces chimiques R-COOH et R-COO- . Quelle
est l’espèce prédominante présente dans l’estomac où le pH est égal à 2
?
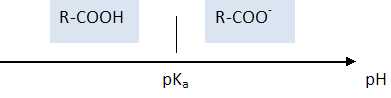
A pH inférieur à pKa ( 3,5), la forme acide
RCOOH du couple acide / base prédomine.
|
|