|
|
Chimie.
Lors d'un effort musculaire intense, il peut y avoir une production
d'acide lactique au sein d'un muscle. Cet excès d'acide lactique peut
être à l'origine de l'apparition de douleurs musculaires.
L'acide lactique a pour formule CH3-CHOH-COOH.
Donner la
définition d'un acide selon Brönsted.
Un acide est une espèce, ion ou molécule, susceptible de céder un
proton H+.
Ecrire
l'équation de la réaction de l'acide lactique avec l'eau.
CH3-CHOH-COOH
aq + H2O(l) = CH3-CHOH-COO-
aq +H3O+aq.
Donner
l'expression de la constante d'acidité Ka du couple
acide lactique / ion lactate.
Ka = [CH3-CHOH-COO-
aq][H3O+aq] / [CH3-CHOH-COOH aq].
Le pKa du couple acide lactique / ion lactate
vaut 3,9.
Tracer le
diagramme de prédominance des espèces notées AH / A-..

Lors d'un effort musculaire intense,
le pH intramusculaire peut varier entre 7,05 et 6,10.
Quelle
espèce chimique prédomine ( acide lactique ou ion lactate ) dans les
muscles et donc reponsable des douleurs musculaires ? Justifier.
A pH supérieur à pKa, la forme ion lactate
prédomine.
La teneur en acide lactique d'un lait est un indicateur de sa
fraîcheur. Le degré de fraîcheur d'un lait peut se vérifier en
déterminant la concentration molaire Ca de
l'acide lactique dans ce lait. Pour ceela, on effectue un dosage
pH-métrique d'un volume Va = 10,0 mL du lait,
par une solution aqueuse d'hydroxyde de sodium ( Na+aaq
+ HO-aq ) de concentration Cb =
0,010 mol/L.
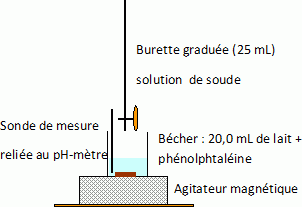
Faire
le schéma annoté du dispositif utilisé pour ce dosage pH-métrique.
Pour cela, choisir le matériel utile dans la liste suivante : verre à
pied, fiole jaugée, bécher, erlenmeyer, burette graduée, pH-mètre,
agitateur magnétique, barreau aimanté, sonde pH-métrique, pipette
jaugée de 10,0 mL.
Faire apparaître clairement sur ce schéma la solution aqueuse
d’hydroxyde de sodium et le lait.
L’équation
de la réaction de dosage s’écrit :
CH3-CHOH-COOH
+ HO- --> CH3-CHOH-COO-
+H2O. (1)
Le suivi
pH-métrique du dosage du lait par la solution aqueuse d’hydroxyde de sodium a permis de tracer la
courbe ci-dessous.
Définir
l’équivalence d’un dosage.
A
l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiomètriques. Avant l'équivalence, l'un des réactifs
est en excès, après l'équivalence, l'autre réactif est en excès.
A l’aide de
l’équation de la réaction, montrer qu’à l’équivalence Ca.Va
= Cb.VbE
où VbE est le volume de solution aqueuse
d’hydroxyde de
sodium versé à l’équivalence.
Quantité de matière d'acide lactique ayant réagi à l'équivalence : Ca.Va.
Quantité de matière d'hydroxyde de sodium versée à l'équivalence : Cb.VbE.
Les nombres stoechiométriques de (1) conduisent à : Ca.Va
= Cb.VbE.
|
.
|
En faisant
apparaître la construction sur la figure,déterminer graphiquement les
coordonnées du point équivalent.
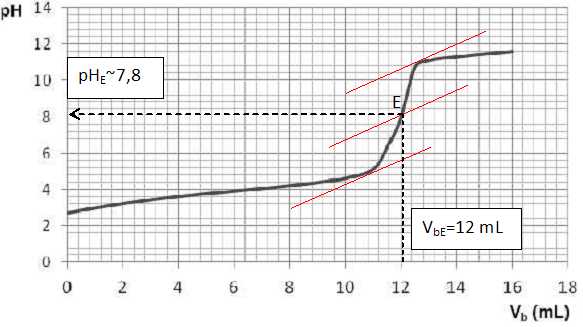
Le volume versé à l’équivalence est VbE = 12,0
mL. Calculer
la concentration molaire Ca en acide
lactique de ce lait.
Ca
= Cb.VbE / Va
= 0,010 *12 / 10 =0,012 mol/L.
La
quantité de matière d’acide lactique présente dans un litre de ce lait
est égale à 1,2 x 10-2 mol.
Calculer
la masse d’acide lactique correspondante. Donnée : Masse
molaire de l’acide lactique : 90 g.mol-1.
0,012 *90 =1,08 ~1,1 g/L.
Un lait est considéré comme frais si la masse d’acide lactique contenue
dans un litre n’excède pas 1,8 g.
Le
lait bu est-il responsable des douleurs gastriques de l’étudiant
?
Non, le lait étudié est frais, la teneur en acide lactique est
inférieure à 1,8 g/L.
Les douleurs musculaires ressenties par l’étudiant peuvent aussi être
dues à un apport insuffisant en dioxygène au niveau du muscle.
Le glutathion présent dans l’hémoglobine améliore le transport du
dioxygène des poumons vers les tissus.
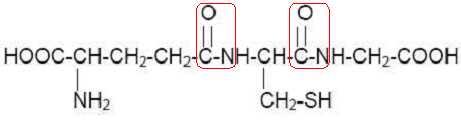
Découvert au XIXème siècle, le glutathion est un tripeptide dont la
formule semi-développée est donnée ci-dessous.
Entourer
une des deux liaisons peptidiques.
L’hydrolyse du glutathion conduit à la formation de l’acide glutamique,
de la cystéine et de la glycine.
L’acide glutamique et la cystéine sont deux molécules dont les formules
semi-développées sont les suivantes :
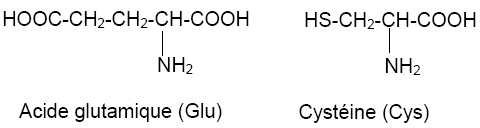
A
quelle famille chimique appartiennent ces deux molécules ? Expliciter
la réponse.
Ces molécules sont des acides a
aminés, elles possèdent une fonction acide carboxylique et une fonction
amine portées par le même carbone.
Recopier
la formule de la cystéine et repérer par un astérisque l’atome de
carbone asymétrique présent dans cette molécule.

|
|
Donner la
représentation en projection de Fischer de la molécule
de cystéine en configuration L.
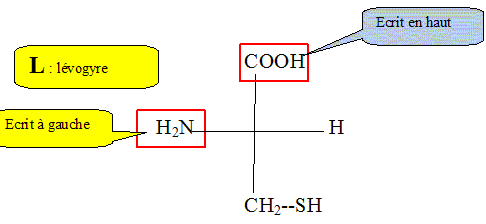
On
souhaite préparer un dipeptide en réalisant un milieu réactionnel
contenant de la cystéine et de la glycine. H2N-CH2-COOH
( Gly).
Nommer les
dipeptides pouvant être obtenus en utilisant les abréviations des
acides α-aminés.
Cys-Cys ; Gly-Gly ; Cys-Gly ; Gly-Cys.
En utilisant les formules semi-développées de la cystéine et de la
glycine, écrire
l’équation de la réaction permettant d’obtenir le dipeptide Cys-Gly.
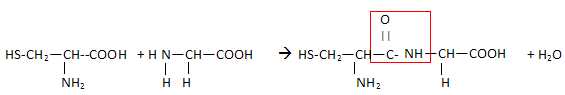
|
|