|
|
Dosage du
dioxyde de soufre dans un vin.
Un laboratoire doit déterminer la concentration en dioxyde de soufre SO2
aq dans un vin blanc. Un technicien dose ce dernier avec une solution
de diiode aqueux. Il introduit dans un erlenmeyer, un volume V = (20,00
±0,05) mL de vin blanc limpide très peu coloré en vert pâle, 4 mL
d'acide sulfurique incolore et 1 mL d'empois d'amidon également
incolore.
La solution titrante de diiode, de concentration en diiode C2
= (1,00 ±0,01) 10-2 mol/L est ensuite ajoutée jusqu'à
l'équivalence répérée par le changement de couleur du milieu
réactionnel.
VE =(6,28 ±0,05) mL.
Equation support du dosage :
I2aq + SO2 aq + 2H2O(l) ---> 2I-aq
+ SO42-aq + 4H+aq. (1).
Justifier le
changement de couleur à l'équivalence.
La seule espèce colorée est le diiode ; ce dernier forme avec l'empois
d'amidon un complexe de teinte violet foncé.
Avant l'équivalence le diiode est en défaut, après l'équivalence, il est
en excès. A l'équivalence, la teinte de la solution passe du vert très pale au violet foncé.
Déterminer la
concentration molaire C1 en dioxyde de soufre de ce vin et
en déduire que sa concentration massique Cmexp =0,201 g/L.
A l'équivalence, d'après les nombres stoechiométriques de (1), les
quantités de matière de diiode et de dioxyde de soufre sont égales.
n(diiode) =n(SO2)= C2VE ; C1=[SO2aq]
=C2VE / V =1,00 10-2 *6, 28 /20,00 =3,14 10-3
mol/L.
Masse molaire du dioxyde de soufre M = 32,1 +2*16 = 64,1 g/mol.
Cmexp =C1 M = 3,14 10-3*64,1 =0,201
g/L.
Déterminer
l'incertitude relative DCmexp
/ Cmexp.
(DCmexp
/ Cmexp)2 = (DVE
/ VE)2 +(DC2
/ C2)2 .
(DCmexp
/ Cmexp)2 = (0,05
/ 6,28)2 +(0,01
/ 1)2 =1,63 10-4 ; DCmexp
/ Cmexp=1,28 10-2~1,3 10-2.
En
déduire un encadrement de Cmexp et conclure.
DCmexp
=1,28 10-2*0,201 =2,6 10-3
g/L.
Cmexp =0,201 ±2,6 10-3 g/L. ( 0,198 ; 0,204).
La réglementation européenne impose que la concentration massique en
dioxyde de soufre ne doit pas dépasser 0,210 g/L dans un vin blanc. Ce
vin respecte cette norme.
|
| .
. |
.
|
Acidité totale
d'un vin et acide tartrique.
Représentation de Cram de l'acide tartrique naturel.
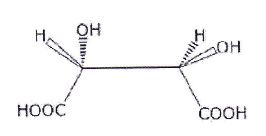
Ecrire
la formule semi-développée de l'acide tartrique et identifier les
groupes fonctionnels présents.
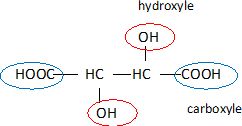
Repérer
les atomes de carbones asymétriques en justifiant.
Un atome de carbone asymétrique est un carbone tétragonal lié à 4
atomes ou groupes d'atomes différents.
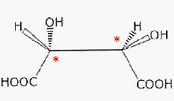
On ajoute à une solution d'acide tartrique une solution d'hydroxyde de
sodium jusqu'à ce que le pH soit égal à 7.
Couples de l'acide tartrique noté AH2 : AH2/AH-
pKa1 = 3,0 ; AH-/A2- : pKa2
= 4,4.
Justifier qu'à pH=7,
l'espèce A2- prédomine.
A pH > pKa2+1, l'espèce A2- est largement
majoritaire.
Choisir parmi les
deux propositions suivantes l'équation de la réaction qui se produit
dans ces conditions entre l'acide tartrique et la soude.
AH2 + HO- ---> AH- + H2O
(1).
AH2 + 2HO- ---> A2- +2H2O (2).
Dans l'état final ( pH=7, A2- majoritaire),
alors on titre les deux acidités de l'acide tartrique.
L'équation support du dosage est : AH2 + 2HO- ---> A2- +2H2O.
|
|
Pour déterminer l'acidité totale d'un vin
blanc, on introduit V = 20,0 mL de vin dans une fiole à vide et on
procède au dégazage du vin.
On doit ajouter Vb = 15,5 mL d'une solution d'hydroxyde de
sodium de concentration Cb=0,100 mol/L à cet
échantillon pour obtenir un mélange de pH=7.
Quel
est l'intérêt du dégazage du vin ?
On élimine le dioxyde de carbone et le
dioxyde de soufre dissous, ces derniers étant des acides, le résultat
de l'acidité totale du vin serait faussée.
Calculer
la quantité de matière d'ion hydroxyde puis la masse d'acide
tartrique pouvant réagir avec cette quantité d'ion hydroxyde.
n(HO-) =VbCb =15,5 10-3
*0,100 = 1,55 10-3 mol.
D'après les nombres stoechiométriques de (2) : n(AH2) = ½n(HO-) = 0,5*1,55 10-3
=7,75 10-4 mol.
M(acide tartrique) = 4*12+6+6*16 =150 g/mol.
Masse d'acide tartrique : 7,75 10-4 *150 =0,11625 ~0,116 g
dans 20,0 mL de vin.
En
déduire l'acidité totale du vin étudié.
0,116 *50 =5,81 g/L équivalent d'acide tartrique.
|
|


