|
|
L'aspartame
est un édulcorant artificiel découvert en 1965. C'est un dipeptide
obtenu par réaction de l'acide aspartique et d'un dérivé de la
phénylalanine, deux acides aminés.
La
phénylalanine et l'acide aspartique.
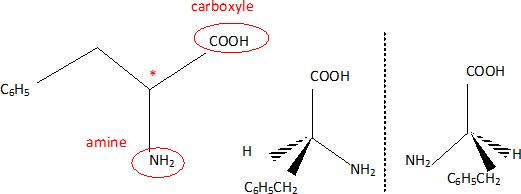
La phénylalanine est un acide aminé essentiel : il doit être
apporté par l'alimentation car
l'organisme est incapable de le synthétiser. On donne la formule de la phénylalanine.
Entourer
et nommer les groupes caractéristiques ; identifier le carbone
asymétrique. Comment peut-on qualifier cette molécule ? Donner les
représentations de Cram des deux énantiomères.
Une molécule possédant un carbone asymétrique est chirale.
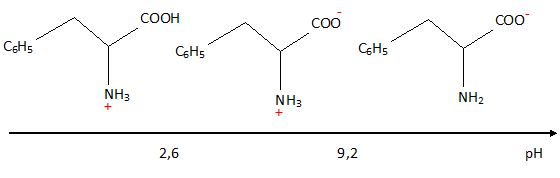
Les
acides aminés sont des molécules ayant des propriétés à la fois acides
et basiques. La forme prédominante de la phénylalanine dépend alors du
pH.
Sur
la figure ci-dessous, indiquer les espèces qui prédominent à pH<2,6
et à pH >9,2.
On donne la formule de l'acide aspartique :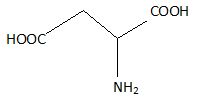
On
s'intéresse au spectre RMN du proton de l'acide aspartique. On donne
les déplacements chimiques de quelques noyaux d'hydrogène. L'hydrogène
concerné est indiqué en gras.
R-CH2-CO-R'
: 2,0 - 4,0 ; RCOOH
: 9,5 - 13 ; R-NH2
: 1,0 - 5,0.
Le spectre RMN de l'acide aspartique présente les signaux suivants :
singulet large à 11 ppm, intégration 2 ; triplet à 3,8 ppm, intégration
1 ; doublet à 2,7 ppm, intégration 2 ; singulet très large à environ 2
ppm, intégration 2.
Attribuer
les signaux observés à chaque hydrogène ou groupe d'hydrogènes
équivalents de la molécule.
Le singulet large à 11 ppm correspond aux deux protons des groupes
carboxyles.
Le singulet très large à 2 ppm correspond aux protons du groupe amine.
Le triplet à 3,8 ppm correspond à : -CH2-CH<
Le doublet à 2,7 ppm correspond à : -CH2-CH<
Interpréter
la multiplicité des pics pour le triplet à 3,8 ppm.
Ce proton n'est pas couplé avec les deux protons du groupe amine voisin.
Ce proton est couplé avec les deux protons du groupe CH2
voisin, d'où un triplet.
|
| .
. |
.
|
Synthèse d'un
dérivé de la phénylalanine.
Protocole de
synthèse.
Protocole n°1
: utilisation du triméthylchlorosilane.
On introduit dans un ballon 10 g de phénylalanine. On additionne
lentement, tout en agitant, 15 mL de triméthylchlorosilane. Un volume
de 60 mL de méthanol est ensuite ajouté au mélange qui est agité
pendant 12 heures à température ambiante. On procède à l'évaporation du
solvant pour obtenir le produit souhaité. Le rendement de la synthèse
est de 96 %.
Protocole n°2 : utilisation
du chlorure de thionyle.
Dans un ballon, 10 g de phénylalanine sont mis en suspension avec 100
mL de méthanol. Sous agitation magnétique, le mélange réactionnel est
refroidi à l'aide d'un bain d'eau glacée puis 6 mL de chlorure de
thionyle sont ajoutés goutte à goutte. Le mélange est maintenu 24 h
sous agitation à température ambiante. Après évaporation du solvant, le
produit obtenu est recristallisé dans un mélange d'éthanol et d'acétate
d'éthyle. Le rendement de la synthèse est de 97 %.
Protocole n°3 : utilisation
de l'acide sulfurique.
On introduit dans un ballon 15 g de phénylalanine, 27 mL de méthanol et
5 mL d'acide sulfurique. Le ballon est placé sous agitation dans un
bain d'eau à 85 °C pendant 4 h. Un volume de 125 mL de méthanol est
ajouté goutte à goutte au mélange par l'intermédiaire d'une ampoule de
coulée. Simultanément l'excès de méthanol est retiré du mélange. Après
4 h on traite l'huile obtenue. Le rendement de la synthèse est de 67 %.
Informations
concernant différentes espèces chimiques.
|
Pictogramme
|
Mention
de danger
|
Tarif
en 2012
|
Phénylalanine
|
|
|
16,90
€ les 25 g
|
Méthanol
|

|
Liquide
et vapeurs très inflammables
Toxique en cas d'ingestion, par inhalation, par contact cutané.
Risque avéré d'effets graves pour les organes.
|
10,90
€ le litre
|
Triméthylchlorosilane
|

|
Liquide
et vapeurs très inflammables
Nocif par contact cutané, provoque des brûlures de la peau et des
lésions oculaires graves.
Toxique par inhalation.
Peut irriter les voies respiratoires.
|
23,30
€ les 30 mL.
|
Chlorure
de thionyle
|
|
Nocif
par inhalation, en cas d'ingestion.
Provoque des brûlures de la peau et des lésions oculaires graves.
Peut irriter les voies respiratoires.
|
22,90
€ les 100 mL
|
Acide
sulfurique
|

|
Provoque
des brûlures de la peau et des lésions oculaires graves. |
8,80
€ le litre
|
Dégager
l'(es) avantage(s) et l'(es) inconvénient(s) de chacun des trois
protocoles proposés. Consigner les réponses dans un tableau.
|
Avantages
|
Inconvénients
|
Protocole
n°1
|
Bon
rendement, la durée du protocole est assez longue mais on opère à
température ambiante.
|
Le
méthanol et le triméthylchlorsilane sont très dangereux pour la santé.
Le triméthylchlorosilane est couteux.
|
Protocole
n°2
|
Bon
rendement, la durée du protocole est très longue mais on opère à
température ambiante. |
Le
méthanol et le chlorure de thionyle sont très dangereux pour la santé.
Le chlorure de thionyle est couteux. |
Protocole
n°3
|
La
durée du protocole est courte, l'acide sulfurique est peu couteux.
|
L'acide
sulfurique est corrosif. Le méthanol est dangereux pour la santé.
Le rendement est mauvais.
La dépense énergétique est importante du fait du chauffage à 85°C.
|
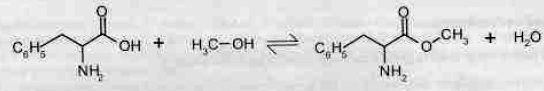
On se propose de préparé au laboratoire l'ester
méthylique de la phénylalanine en adoptant le protocole n°3 au matériel
disponible au laboratoire.
L'équation de la réaction est donnée ci-dessous :
Protocole
retenu : On introduit dans un ballon une masse m = 16,5 g de
phénylalanine et un volume V = 40 mL de méthanol. On ajoute quelques
millilitres d'une solution aqueuse concentrée d'acide sulfurique. On
chauffe à reflux pendant 4 h puis on laisse refroidir le mélange à
température ambiante. Une solution d'hydrogénocarbonate de sodium est
ensuite versée dans le ballon afin de neutraliser les acides présents
dans le milieu réactionnel.
Le mélange est placé dans une ampoule à décanter et l'ester est extrait
par du dichlorométhane. La phase organique est recueillie, lavée,
séchée sur du sulfate de sodium anhydre. Après filtration et
évaporation du dichlorométhane, on recueille une masse m' = 11,4 g
d'ester.
Masse molaire ( g/mol ): phénylalanine : 165 ; méthanol : 32 ; ester :
179.
Masse volumique ( g/mL) : eau : 1,0 ; méthanol : 0,79 ; dichlorométhane
: 1,3.
Comparaison des électronégativités : c(O)
> c(C).
Quelles
sont les précautions opératoires à respecter pour mettre en
oeuvre cette synthèse ?
Port de blouse, gants et lunette de protection ; travailler sous hotte,
le méthanol étant toxique par inhalation.
La réaction d'estérification est lente. Comment, dans ce
protocole, la transformation chimique a-t-elle été accélérée ?
L'acide sulfurique est un catalyseur. La température est un facteur
cinétique, d'où le rôle du chauffage à reflux.
Dans
le cas précis de cette synthèse, justifier l'impossibilité d'évaluer la
durée de cette transformation chimique par un suivi par chromatographie
sur couche mince.
La transformation conduit à un équilibre chimique : dans le milieu
réactionnel, on trouvera toujours la phénylalanine, le méthanol et
l'ester méthylique de la phénylalanine.
Evaluer
le rendement de cette synthèse organique en explicitant la démarche
suivie.
Quantités de matière initiales : phénylalanine : 16,5 / 165 = 0,10 mol
; méthanol : 40*0,79 / 32 =0,99 mol ( en large excès).
Dans l'hypothèse d'une transformation totale, on peut espérer obtenir
une quantité de matière d'ester égale à 0,10 mol soit 0,10 *179 = 17,9
g.
Rendement : masse réelle / masse théorique : 11,4 / 17,9 =0,64 ( 64 %).
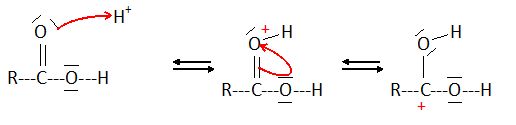
La première étape du mécanisme réactionnel, reproduite ci-dessous,
permet d'illustrer le rôle des ions H+ dans la synthèse de
l'ester méthylique.

Une fois fixés, les ions H+ permettent d'augmenter le
caractère accepteur de doublets d'électrons d'un des atomes de la
liaison C=O ce qui augmente la vitesse de la réaction à l'échelle
macroscopique.
Quelle
espèce chimique introduite dans le milieu permet d'apporter les ions H+ nécessaires ?
L'acide sulfurique.
Représenter
sur votre copie la formule simplifiée obtenue à l'issue de la première
étape et localiser l'atome accepteur de doublets d'électrons de la
liaison C=O. Relier par une
flèche courbe les sites donneur et accepteur d'électrons afin
d'expliquer la formation de la nouvelle liaison.
L'atome de carbone de la liaison C=O est accepteur de doublet
d'électrons.
|
Synthèse de
l'aspartame.
Le groupe amino réagit avec le groupe carboxyle suivant :

Ainsi l'acide aspartique et l'ester méthylique de la phénylalanine
réagissent entre eux pour former l'aspartame dont la formule est donnée
ci-dessous.
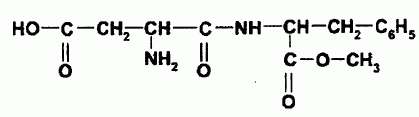
Donner
le nom du groupe caractéristique qui a été créé lors de la synthèse de
l'aspartame.
Le groupe -CO-NH- est le groupe amide ou encore appelé liaison
peptidique..
Lorsqu'on analyse le milieu réactionnel obtenu à la fin de la synthèse
par une chromatographie sur couyche mince ( CCM) on observe plusieurs
taches a des hauteurs différentes de celles des réactifs. Sachant que
l'eau n'apparaît pas sur la plaque de chromatographie, proposer une
explication à ce constat expérimental.
L'ester méthylique de la phénylalanine possède un groupe amino et aucun
groupe carboxyle.
L'aspartame possède un groupe amino et deux groupes carboxyles.On peut
donc obtenir plusieurs dipeptides différents.
L'aspartame possède un groupe amino et un groupe carboxyle : la
réaction peut donc conduire à d'autres polypeptides.
Ecrire
la formule semi-développée d'une molécule autre que l'aspartame
présente dans le milieu réactionnel à la fin de la synthèse.
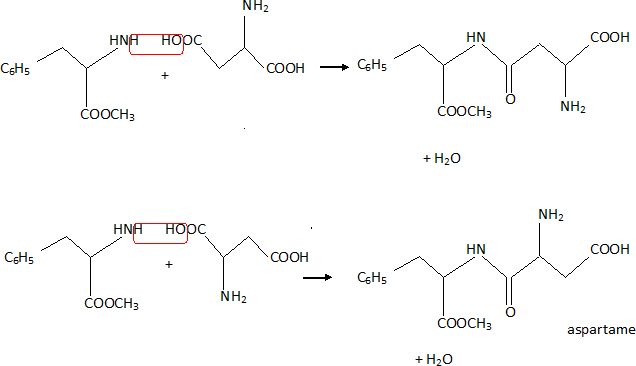
Pour synthétiser l'aspartame, la stratégie de synthèse consiste à
protéger le groupe NH2 et l'un des deux groupes COOH
de l'acide aspartique à l'aide de groupe protecteur noté G' ou G.
L'acide aspartique protégé réagit alors avec le dérivé de la
phénylalanine protégé pour donner la molécule suivante, notée A.
Ecrire la formule
semi-développée de l'acide aspartique protégé.
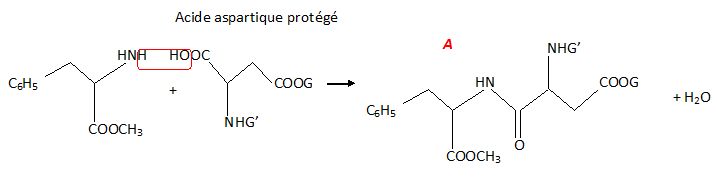
Que
faut-il faire ensuite pour obtenir l'aspartame à partir de A ? Aucune écriture de réaction chimique n'est
demandée.
Il faut retirer les deux groupes protecteurs G et G' après avoir isolée
A du milieu réactionnel.
En utilisant le
tableau ci-dessous et votre sens critique, expliquer s'il est judicieux
d'utiliser la spectroscopie infrarouge pour s'assurer de l'obtention de
l'aspartame au regard de la nature des liaisons formées ou rompues au
cours de la transformation chimique.
Liaison
|
Nombre
d'onde ( cm-1)
|
Intensité
F : forte ; m : moyen.
|
Espèce
|
N-H
|
3300-3500
|
m(
2 bandes)
|
amine
primaire
|
N-H
|
3300
- 3500
|
m(
une bande)
|
amine
secondaire
|
N-H
|
3100
-3500
|
F
|
amide
|
C-H
|
2850-3000
et 1430-1480
|
F
|
alcane
|
O-H
|
2500
- 3200
|
F
à m(large)
|
acide
carboxylique
|
C=O
|
1700
-1725
|
F
|
acide
carboxylique
|
C=O
|
1735
- 1750
|
F
|
ester
|
C=O
|
1630-1700
|
F
|
amide
|
|
|
|
|
L'aspartame,
l'acide aspartique et l'ester méthylé de la phénylalanine possèdent une
fonction amine primaire ( 2 bandes moyenne à 3300- 3500 cm-1).
Par contre l'aspartame possède en plus une bande N-H forte (
amide ) entre 3100 et 3500 cm-1.
La phénylalamine, l'acide aspartique présentent une bande forte (
groupe C=O ) entre 1700 et 1750 cm-1. L'aspartame présentera
en plus une bande forte entre 1630 et 1700 cm-1 ( C=O du
groupe amide ).
On peut donc s'assurer de la formation de l'aspartame par la
spectroscopie IR, à condition de partir de l'acide aspartique protégé.
Mais il vaudrait mieux en plus utiliser la RMN du proton.
|
|













