|
|
A
haute température l'acide nitrique HNO3 réagit
sur le propane en donnant du nitropropane suivant un processus
radicalaire. L'acide nitrique se décompose suivant :
HO-NO2 --> HO. + .NO2.
Le propane se décompose suivant : C3H8
--> .C3H7
+ H..
Tous les atomes d'hydrogène de la molécule possèdent la même
probabilité d'être arraché.
Montrer
qu'il peut se former deux isomères du nitropropane.
CH3-CH(NO2)-CH3
2-nitropropane et O2NCH2-CH2-CH3
1-nitropropane.
Calculer
le pourcentage de chacun d'eux.
Il y a deux type d'atomes
d'hydrogène : 6 hydrogène sur les groupes méthyle CH3
et 2 hydrogène sur le groupe -CH2-. La
probabilité pour un hydrogène d'être arraché étant la même, on
obtiendra 75 % de 1-nitrométhane et 25 % de 2-nitropropane.
On peut aussi obtenir le 1-nitropropane en faisant réagir le
1-bromopropane sur le nitrite de sodium ( composé ionique de formule
NaNO2 ). Cette réaction se fait à température
ambiante, à condition d'utiliser un solvant particulier, le DMF ( N,N
diméthylméthanamide (CH3)2N-CHO
).
A
quelle catégorie de solvant appartient le DMF ?
C'est un solvant polaire aprotique à haut point d'ébullition.
Le DMF présente un spectre RMN intéressant. A température ambiante, on
bserve trois pics :
8,06 ppm : fonction aldehyde ; les deux méthyles donnent deux singulets
sépaés à 2,78 ppm et 2,95 ppm.
A température élevée, 150 °C, le pic à 8,06 ppm reste inchangé, mais
les deux autres pics n'en forment plus qu'un.
Donner une
explication.
On peut écrire deux formes mésomères du DMF :
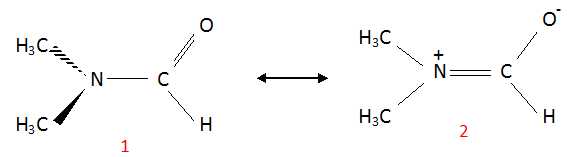
(1) possède un plan de symétrie, les deux groupes méthyles ont le même
environnement et donnent un seul signal RMN. (2) ne posède
pas d'élément de symétrie, les deux groupes méthyles ne possèdent pas
le même environnement et conduisent à deux sigulets distincts.
|
| .
. |
.
|
La
réaction du 1-bromopropane sur le nitrite de sodium est une
substitution nucléophile.
Donner
la première étape de cette substitution et en déduire l'équation de la
réaction.
CH3-CH2-CH2-Br
--> CH3-CH2-CH2+
+ Br-.( étape lente )
suivi d'une étape rapide : CH3-CH2-CH2+
+ NO2--->CH3-CH2-CH2-NO2.
ou bien en une seule étape :
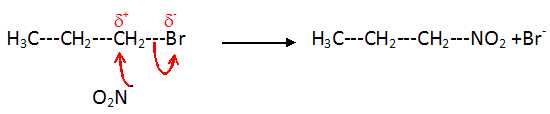
On peut envisager une autre première
étape qui conduirait à un autre isomère du 1-nitropropane.
Quel
serait la formule semi-développée de cet isomère ?
CH3-CH(NO2)-CH3
2-nitropropane.
|
|
Si
l'on doit produire du 1-nitropropane industriellement, quels seront les
avantages et les inconvénients des deux méthodes ?
Chaque étape d'une synthèse doit posséder le rendement le plus élevé
possible.
Chaque réaction doit être rapide, conduire à un seul produit et
s'effectuer dans des conditions de température et de pression peu
contraignantes.
Les étapes de séparation du produit recherché du milieu
réactionnel doivent être simples et peu nombreuses.
Les deux synthèses conduisent à 2 isomères qu'il faudra ensuite
séparer. La première nécessite une dépense énergétique importante (
température élevée ). La seconde ne présente pas cet inconvénient.
|
|