|
|
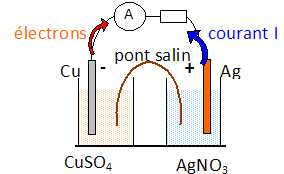
On forme la pile argent / cuivre en associant :
-
une demi-pile A constituée d'une électrode d'argent, de masse en
excès, plongeant dans V =1,0 L d'une solution aqueuse de nitrate
d'argent ( Ag+ aq + NO3-aq ) à c=0,10 mol/L.
- une demi-pile B
constituée d'une électrode de cuivre, de masse en excès, plongeant dans
V =1,0 L d'une solution aqueuse de sulfate de cuivre ( Cu2+ aq + SO42-aq ) à c=0,10 mol/L.
La réaction 2Ag+aq + Cu(s) = Cu2+aq + 2Ag(s) a pour constante d'équilibre K = 2,15 1015 à 25°C.
Donner
l'expression du quotient de réaction et calcular sa valeur
initiale. En déduire le sens de la réaction globale ayant lieu
dans la pile.
Qr = [Cu2+aq] /[Ag+aq]2 ;
Qr , i = [Cu2+aq]i /[Ag+aq]i2 = 0,10 / 0,102 = 10.
Qr , i < K : évolution spontanée dans le sens direct.
Ecrire
les demi-équations des réactions qui se produisent à chaque électrode
et préciser s'il s'agit d'une réduction ou d'une oxydation.
Oxydation à l'anode négative : Cu(s) = Cu2+aq + 2e-.
Réduction à la cathode positive : 2Ag+aq +2e- = 2Ag(s).
Quelle est l'électrode positif de la pile ? Justifier.
Ecrire
la relation entre la quantité d'électricité Q et la quantité d'électrons échangés.
Q = n(e-) F = 9,65 104 n(e-).
Calculer la quantité d'électricité maximale que peut fournir cette pile.
Ag+aq +e- = Ag(s).
n(Ag+aq) = n(e-) = c V = 0,10 *1,0 = 0,10 mol.
Q = 0,10 * 9,65 104 = 9,65 103 C.
|
