|
.
|
|
La bétadine.
La bétadine est un antiseptique en solution aqueuse. Son principe actif est le diiode I2. sur la notice, figure la concentration en diiode : c0 =1,0 10-2 mol L-1. On se propose de vérifier cette concentration.
L'équation de la réaction de titrage est :
I2 + 2S2O32- = 2I- +S4O62-.
Donner les deux
couples oxydant / réducteur qui intreviennet dans cette réaction
en précisant pour chaque couple l'oxydant et le réducteur.
I2 ( oxydant) / I- ( réducteur) ; S4O62-(oxydant ) / S2O32-( réducteur ).
Définir oxydant.
Un oxydant est une espèce susceptible de gagner un ou plusieurs électrons.
Qu'appelle-t-on réaction d'oxydo-réduction ?
Le réducteur d'un couple oxydant / réducteur échange un ou des électrons avec l'oxydant d'un autre couple.
Décrire le protocole expérimental permettant de préparer V1 = 10,0 mL de solution S1 de bétadine diluée 10 fois.
On
dispose de pipettes jaugées de 1mL, 5 mL, 10 mL, 20 mL, d'éprouvettes
graduées de 10 mL, 50 mL, 100 mL et de fioles jaugées de 200 ml et 500
mL.
Prélever 20,0 mL de solution commerciale à l'aide d'une pipette
jaugée. Placer dans une fiole jaugée de 200 mL et compléter avec de
l'eau distillée jusqu'au trait de jauge. Boucher et agiter pour rendre
homogène.
Quelle est la valeur de la concentration c1 de la solution diluée ?
c1 = c0 / 10 = 1,0 10-3 mol/L.
Le prélèvement de volume V1 = 10,0 mL est titré par une solution de thiosulfate de potassium de concentration c2 = 1,00 10-3 mol/L. La décoloration se produit après avoir versé le volume VE = 19,5 mL de solution titrante.
Compléter le tableau d'avancement.| état | avancement (mol) | I2 | + 2S2O32- | = 2I- | +S4O62- | | initial | 0 | c1V1 | c2VE | 0 | 0 | | en cours | x | c1V1-x |
|
|
| | équivalence | xmax | c1V1-xmax = 0 | c2VE-2xmax = 0 | 2xmax | xmax |
xmax = ½c2VE= 0,5 *1,00 10-3 * 19,5 =9,75 10-3 mmol.
Calculer c1 et conclure.
c1=xmax / V1= 9,75 10-3 /10 =9,75 10-4 mol/L.
écart relatif : (10-3 -9,75 10-4) / 10-3 = 2,5 10-2 ( 2,5 %).
A 2,5 % près l'indication lue sur le flacon de bétadine et le résultat du titrage concordent.
|
| .
. |
.
L'ibuprofène.
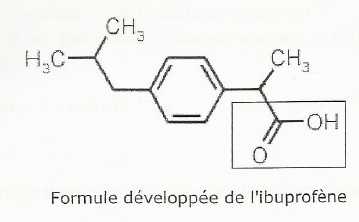
Identifier le groupe fonctionnel encadré.
Groupe carboxyle.
On dissout un comprimé d'ibuprofène dans V = 50 mL de solution d"hydroxyde de sodium de concentration c = 4,00 10-2 mol/L. l'ibuprofène réagit totalement avec les ions hydroxyde versés en excès.
Déterminer la masse d'hydroxyde de sodium à dissoudre dans 50 mL pour obtenir une telle concentration.
n = cV = 4,00 10-2 *0,050 = 2,0 10-3 mol.
m = n M(NaOH) = 2,0 10-3 *40 =8,0 10-2 g.
Ecrire
l'équation de la réactin entre les ions hydroxyde et l'ibuprofène noté AH.
HO-aq + AH aq ---> H2O (l) + A-aq.
On prélève 10 mL de la solution obtenue et on
dose les ions hydroxyde restant dans la solution à l'aide d'une
solution A d'acide chlorhydrique de concentration cA = 4,00 10-2 mol/L. On obtient un volume équivalent VE = 5,2 mL. Définir l'équivalence.
A
l'équivalence les quantités de matière des réactifs sont en proportions
stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès,
après l'équivalence, l'autre réactif est en excès.
Calculer la quantité de matière d'ion oxoium ayant réagi.
n = cA VE =4,00 10-2 *5,2 =0,208 ~0,21 mmol
Montrer que la quantité d'ion hydroxyde ayant réagi avec l'ibuprofène est 9,6 10-4 mol.
0,208
mmol d'ion hydroxyde en excès dans 10 mL de solution d'hydroxyde
de sodium ayant dissout l'ibuprofène, soit 5*0,208 = 1,04 mmol d'ion
hydroxyde en excès dans 50 mL de cette solution.
Quantité initiale d'ion hydroxyde : 2,0 mmol.
Quantité de matière d'ion hydroxyde ayant réagi avec l'ibuprofène : 2,0 -1,04 = 0,96 mmol = 9,6 10-4 mol.
Déterminer la masse d'ibuprofène dans le comprimé sachant que 1 10-4 mol d'hydroxyde de sodium réagit avec 20,63 mg d'ibuprofène.
9,6*20,63 =198 mg.
|
|
