|
.
|
|
Un
catalyseur permet d'augmenter la vitesse de réaction.
A) De n'importe quelle transformation chimique. Faux.
D'une transformation
thermodynamiquement possible,
c'est à dire spontanée.
B) Seulement d'une transformation spontanée. Vrai..
C) D'une transformation spontanée mais juste en début de réaction. Faux.
L'efficacité
d'un catalyseur en phase hétérogène :
A) augmente quand la surface active du catalyseur croît. Vrai.
B) diminue quand la surface
active du catalyseur croît. Faux.
C) est indépendante de sa surface. Faux.
Un catalyseur est capable
de modifier :
A) la valeur de l'avancement final de la réaction. Faux.
La vitesse croît, la
composition de l'état final n'est pas modifiée.
B) la constante d'équilibre de la réaction. Faux.
La constante d'équilibre
ne dépend que de la température.
C) le temps de demi-réaction. Vrai.
Pour
un système chimique en équilibre, un catalyseur accélère :
A) uniquement la réaction directe. Faux.
Un catalyseur ne modifie
pas la composition d'un système à l'équilibre. Il y a égalité des vitesses de la réaction
directe et de la réaction inverse.
B) davantage la réaction directe que la réaction
inverse. Faux.
C) autant la réaction
directe que la réaction inverse.Vrai.
|
.
Hydrolyse de l'urée.
L'hydrolyse de l'urée est une transformation chimique d'équation :
CO(NH2)2 aq + 2H2O(l) = 2NH4+aq + CO32-aq.
La
transformation s'effectue à 37°C et à volume constant V = 1,0 L en
présence soit d'un catalyseur inorganique, soit d'une enzyme : l'uréase.
Les courbes suivantes donnent l'évolution de la concentration en
urée en fonction du temps suivant la nature du catalyseur.
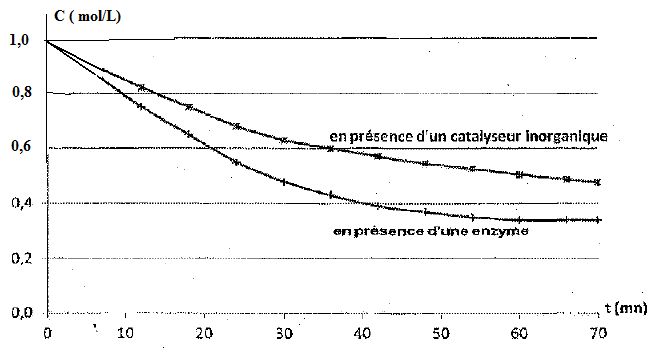
Définir la vitesse volumique de la réaction. Préciser la méthode permettant de calculer la valeur de la vitesse volumique de réaction à la date t.
v = 1/V dx/dt = -dc/dt avec x : avancement (mol) et c : concentration en urée ( mol/L).
Pour déterminer graphiquement v, à la date t, on trace la tangente à la
courbe à la date t et on détermine son coefficient directeur.
Comparer, à la date t= 20 min, les vitesses volumiques des réactions catalysées. Quel est le catalyseur le plus efficace ?
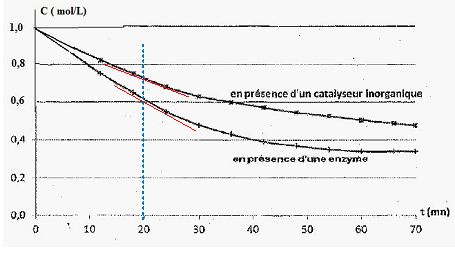
En présence d'une enzyme, la catalyse est plus efficace : la tangente
est plus inclinée par rapport à l'horizontale, son coefficient
directeur est plus grand, la vitesse de la réaction est plus importante.
Que peut-on dire de l'hydrolyse effectuée en présence d'uréase à partir de la date t = 60 min ?
La tangente à la courbe est horizontale : son coefficient directeur est
nul et la vitesse de la réaction est nulle. L'hydrolyse est terminée,
il reste de l'urée ( c est différent de zéro ) ; la réaction
d'hydrolyse de l'urée est limitée.
Donner l'expression de la constante d'équilibre K de l'hydrolyse de l'urée.
K = [NH4+aq]2[CO32-aq] / [CO(NH2)2 aq].
Calculer
les concentrations des espèces chimiques présentes dans le milieu
réactionnel lorsque celui-ci n'évolue pluis pour la transformation en
présence d'uréase.
Graphiquement on trouve : [CO(NH2)2 aq] ~0,32 mol/L.
état
|
avancement volumique ( mol/L)
|
CO(NH2)2 aq |
+ 2H2O(l) |
= 2NH4+aq |
+ CO32-aq |
initial
|
0
|
1,0
|
solvant
en large excès
|
0
|
0
|
équilibre
|
x =0,68
|
1,0-x =0,32
|
2x = 1,36
|
x =0,68
|
Calculer K. Cette valeur est-elle différente suivant la nature du catalyseur utilisé ?
K = 1,362 *0,68 / 0,32 = 3,9.
K ne dépend que de la température et pas de la nature du catalyseur.
|
|

