|
.
|
|
Détermination de la concentration d'une solution d'acide benzoïque par titrage.
On place dans un becher un volume V0 = 100,0 mL d'une solution aqueuse S0 d'acide benzoïque de formule C6H5-COOH et on plonge dans cette solution une cellule de conductimétrie étalonnée.
On ajoute progressivement dans le becher, à l'aide d'une burette
graduée, une solution aqueuse d'hydroxyde de sodium de concentration cB =0,10 mol/L en notant lors de chaque ajout, la conductivité s de la solution lorsque l'équilibre chimique est atteint.
Ecrire l'équation modélisant la transformation qui se produit au cours de ce titrage.
C6H5-COOH aq + HO-aq ---> C6H5-COO- aq + H2O(l).
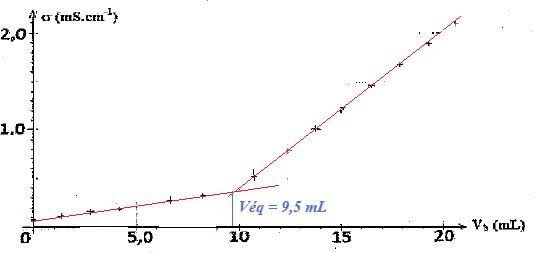
Définir l'équivalence et déterminer la concentration c0 de la solution d'acide bebzoïque.
A
l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'un des réactifs
est en excès, après l'équivalence, l'autre réactif est en excès.
c0V0 = cB Véq ; c0 = cB Véq / V0 = 0,10 *9,5 / 100 = 9,5 10-3 mol/L.
|
.
Constante d'acidité de l'acide benzoïque.
A l'aide de la solution S0 on prépare des solutions diluées de concentrations décroissantes et on mesure la conductivité de chaque solution.
c ( mol/L)
|
1,0 10-2
|
5,0 10-3 |
2,5 10-3 |
2,0 10-3 |
1,0 10-3 |
6,7 10-4 |
5,0 10-4 |
s(µS cm-1)
|
272,8
|
189
|
131
|
115
|
78,5
|
61,7
|
52,1
|
Ecrire l'équation de la réaction entre l'acide benzoïque et l'eau.
C6H5-COOH aq + H2O(l)---> C6H5-COO- aq + H3O+aq .
On considère un volume V de la solution d'acide benzoïque de concentration molaire c.
Etablir en fonction de l'avancement final xf, de la concentration c et du volume V, l'expression de la constante d'acidité Ka du couple de l'acide benzoïque ?
Ka = [C6H5-COO-][H3O+] / [C6H5-COOH].
[C6H5-COO-]=[H3O+] = xf / V ; [C6H5-COOH] = c -xf / V.
Ka = (xf / V)2 / (c -xf / V).
Exprimer Ka en fonction du taux d'avancement final t et de c.
t = xf / xmax = xf /(cV) ; Ka = (t c )2 / (c -t c ) = t2c / (1-t).
Donner l'expression de la conductivité s de la solution. Les ions hydroxydes sont minoritaires en milieu acide.
s = lH3O+ [H3O+] +lC6H5-COO-[C6H5-COO-].
En déduire la relation entre la conductivité, le taux d'avancement final, la concnetration et a = lH3O+ +lC6H5-COO-.
s = lH3O+ xf / V +lC6H5-COO-xf / V = a xf / V = a t c.
|
On trace la courbe représentant les variations de s2/c en fonction de s/c pour les différentes solutions d'acide benzoïque.
La droite de linéarisation obtenue a pour équation : s2/c = -2,7 10-3 s/c +8,1 10-2.
Déterminer Ka à la température de l'expérience.
Ka = t2c / (1-t) avec t = s / (ac).
t2c = Ka(1-t) ; ( s / (ac))2 c = Ka(1-s / (ac)) ;
s2 / c = a2Ka(1-s / (ac)) ; s2 / c = a2Ka- s aKa/ c) ;
On identifie : a2Ka= 8,1 10-2 ; aKa =2,7 10-3.
a = 2,7 10-3/ Ka ; (2,7 10-3/ Ka)2 Ka= 8,1 10-2 ;
(2,7 10-3)2/ Ka= 8,1 10-2 ;
Ka= (2,7 10-3)2/ (8,1 10-2) =9,0 10-5.
|
|
