|
|
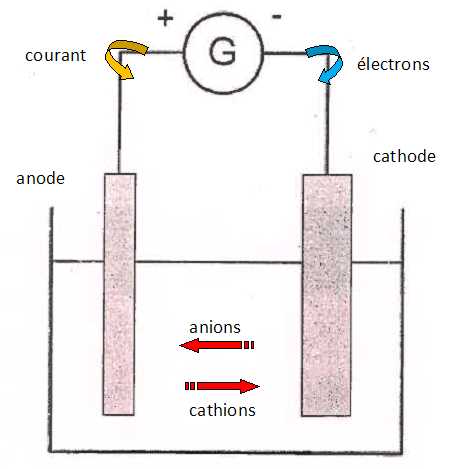
La purification des métaux par électrolyse est possible grâce à l'emploi d'une anode soluble.
-
Le métal impur ( cuivre de pureté 98 à 99 % ) constitue l'anode
soluble. Ce métal subit une oxydation et passe à l'état d'ion en
solution. Les impuretés libérées tombent au fond de l'électrolyseur ou
restent en suspension dans la solution électrolytique.
- A la cathode, les ions cuivre (II) Cu2+aq en solution subissent une réduction, le métal très pur se dépose.
La solution électrolytique contient des ions Cu2+aq, SO42-aq et de l'acide sulfurique.
Le schéma suivant illustre le montage d'une telle électrolyse.
Compléter le schéma.
Ecrire les équations des transformations qui se déroulent aux électrodes. En déduire le bilan de l'électrolyse.
Oxydation du cuivre solide à l'anode : Cu(s) anode = Cu2+ aq + 2e-.
Réduction des ions cuivre (II) à la cathode : Cu2+ aq + 2e- = Cu(s) cathode.
Cu(s) anode + Cu2+ aq + 2e- = Cu2+ aq + 2e-+ Cu(s) cathode.
Simplifier : Cu(s) anode = Cu(s) cathode.
Pourquoi qualifie-t-on cette électrolyse à "anode soluble".
Le métal de l'anode est oxydé, il disparaît sous forme d'ion en solution aqueuse.
La concentration en ion cuivre (II) de la solution varie-t-elle au cours de l'éectrolyse ? Justifier.
A
chaque instant il disparaît autant d'ion cuivre (II) à la cathode
qu'il en apparaît à l'anode. La concentration en ion cuivre (II)
reste consatnte.
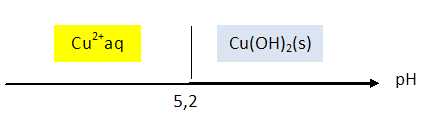
En fonction du pH de la solution dans laquelle il se trouve, l'élément cuivre en solution peut exister sous deux formes : Cu2+aq et Cu(OH)2(s). Le produit de solubilité de Cu(OH)2(s) est Ks = 2,2 10-20.
Déterminer le pH de début de précipitation d'une solution d'ions cuivre (II) à 10-2 mol/L.
Cu2+aq + 2HO-aq = Cu(OH)2(s). Ks = [Cu2+aq][HO-aq]2.
[HO-aq] = ( Ks / [Cu2+aq] )½ = ( 2,2 10-20 / 0,01 )½ =1,48 10-9 mol/L.
[H3O+aq] = 10-14 / [HO-aq]= 10-14 / 1,48 10-9=6,74 10-6 mol/L.
pH = - log (6,74 10-6)=5,17 ~5,2.
|
| .
. |
En déduire le diagramme de prédominance de l'ion cuivre (II).
Expliquer qualitativement pourquoi on ajoute de l'acide sulfurique dans la solution électrolytique.
L'acide sulfurique abaisse le pH de la solution en dessous de 5,2, ce qui évite la précipitation de l'hydroxyde de cuivre (II).
On
désire déposer par électrolyse une couche de cuivre sur une plaque
d'acier. Le dispositif est monté de telle façon qu'une seuleface de la
plaque d'acier puisse être recouverte de cuivre. la durée de
l'électrolyse est Dt = 30,0 min et l'intensité du courant est I = 400 mA.
La plaque d'acier doit-elle jouer le rôle d'anode ou de cathode ?
Les ions cuivre (II) de la solution sont réduits à la cathode et se déposent sur l'acier.
Exprimer la quantité d'électricité Q qui a traversé le circuit.
Q = I Dt.
Exprimer Q en fonction de la quantité de matière d'électrons ne de NA et e.
Q = ne NA e.
|
Exprimer ne en fonction de nCu ( quantité de matière de cuivre formé ).
Cu2+aq + 2e- = Cu(s).
ne = 2 nCu.
En déduire l'expression de nCu puis mCu, masse de cuivre déposée. Calculer cette masse.
nCu = ½ne =½ I Dt / (NA e).
mCu = nCu M(Cu) = ½ I Dt M(Cu) / (NA e).
mCu = 0,5 *0,400 *30,0 *60 *63,5 /(6,02 1023 *1,60 10-19) = 0,237 g.
On observe en réalité lors de l'électrolyse une variation de la masse de la lame de cuivre de 0,241 g.
Proposer une explication.
A la cathode, d'autres réductions peuvent se produire : réduction de l'eau et des ions H+aq en dihydrogène.
|
|

