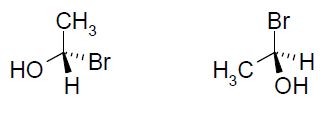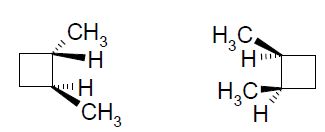|
Chimie organique, : concours technicien chimiste Lille 2011. |
||||||||
| .
. |
||||||||
|
||||||||
|
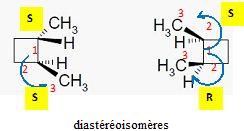
Atome de carbone tétragonal lié à 4 atomes ou groupes d'atomes différents. Indiquer le nombre de carbones asymétriques, le nombre de stéréoisomères possibles ainsi que les fonctions caractéristiques présentes. 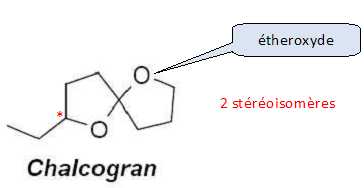 Un atome de carbone tétragonal lié à 4 groupes d'atomes différents, et appartenant à 2 cycles ne donne pas deux stéréoisomères : la structure est rigide. 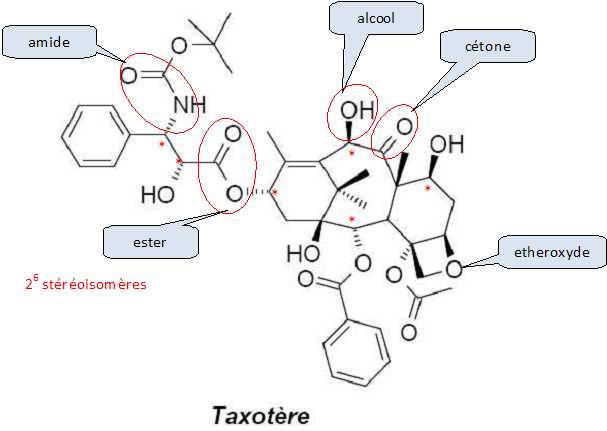
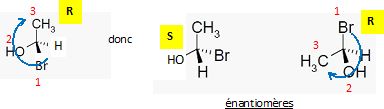
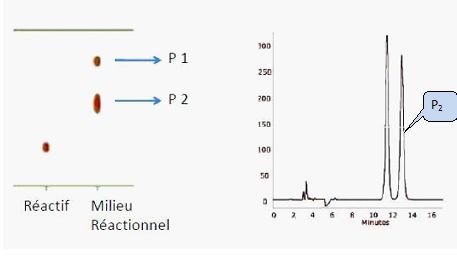
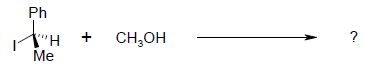 Sachant que la vitesse de la réaction ne dépend que de la concentration en dérivé halogéné, en déduire : - la nature de la réaction mise en jeu : SN1 substitution nucléophime monomoléculaire. - le nombre de produits obtenus : l'étape cinétiquement déterminante est la formation d'un carbocation plan, stabilisé par résonance. La seconde étape est rapide : l'attaque peut se faire de chaque côté du plan de manière équiprobable. On obtient donc un mélange racémique ( deux produits) sans activité optique. - Dessiner le (s) produit(s) obtenu(s).  On étudie le spectre RMN 1H de la molécule de (1S, 2R)-(+)-2-amino-1-phényl-1-propanol dans le chloroforme deutéré CDCl3. Dessiner la molécule en respectant les stéréochimies indiquées. 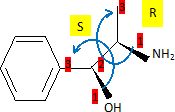
Attribuer les signaux RMN 1H de la molécule avec les déplacements chimiques et les multiplicités quand cela est possible. 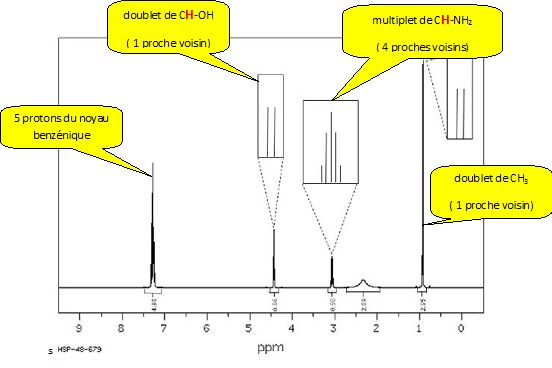 Le spectre RMN 1H de la molécule sera t-il modifié si on inverse la stéréochimie : - d'un des deux carbones asymétriques ? Oui : les signaux de diastéréo-isomères différent par leurs déplacements chimiques. - des deux carbones asymétriques ? Non : deux énantiomères présentent des spectres RMN parfaitement identiques en phase liquide.
|
||||||||
|
|
||||||||