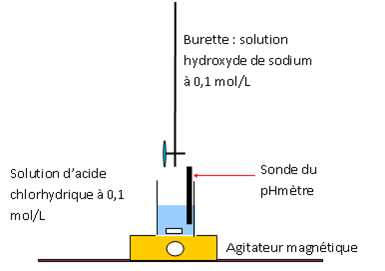
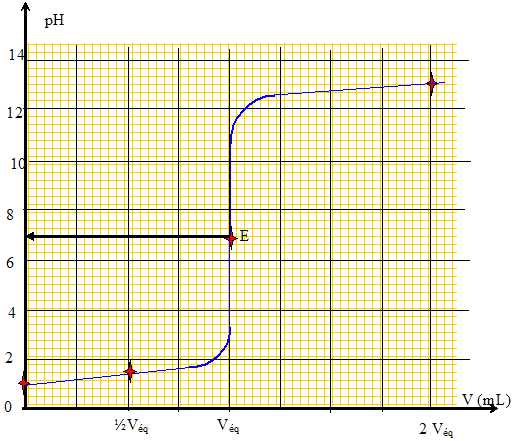
|
Atomes, solutions aqueuses : pHmétrie, solubilité, oxydoréduction, catalyse : concours technicien chimiste Lille 2011. |
||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
B( Z=5) : 1s2 2s2 2p1. Fe ( Z=26) : 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Ar ( Z=18) : 1s2 2s2 2p6 3s2 3p6. Ca2+ ( Z = 20) : 1s2 2s2 2p6 3s2 3p6 . S2-(Z =16) : 1s2 2s2 2p6 3s2 3p6 . Br-(Z =35 ) : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6. Ca2+, S2- , Ar sont isoélectroniques. Indiquer la dénomination des familles d'éléments des colonnes 1, 2, 17 et 18. Alcalins, alcalinoterreux, halogènes, gaz nobles. Soit la réaction de désintégration radioactive de l'isotope 238 de l'uranium : 23892U ---> 23490Th + 42He + g. Définir le terme isotope. Deux isotopes de diffèrent que par leur nombres de neutrons : ils ont le même numéro atomique Z. Que signifient les chiffres 238 et 92 pour l'uranium ? Définir ces grandeurs caractéristiques. 238 : nombres de nucléons ( protons et neutrons) ou nombre de masse ; 92 : nombre de protons ou numéro atomique ou nombre de charge. Quel est le type de radioactivité mise en oeuvre ? Comment arrêter ce rayonnement ? Un photon gamma est émis ainsi qu'un noyau d'hélium ( radioactivité de type alpha ). Les rayons alpha sont facilement arrêtés par une simple feuille de journal. Les rayons gamma sont arrêtés par quelques décimètres de plomb. Quelle est la loi de décroissance radioactive ? Comment définissez-vous la période d'un radioélément ? 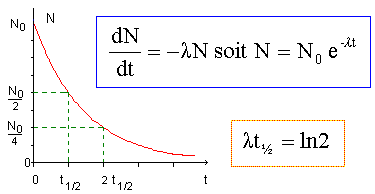 La demi-vie radioactive,(ou période) notée t½, d'un échantillon de noyaux radioactifs est égale à la durée au bout de laquelle la moitié des noyaux radioactifs initiaux se sont désintègrés.
Une solution saturée d'hydroxyde de nickel Ni(OH)2 présente un pH égal à 9,2 à 298 K. Le produit ionique de l'eau vaut 10-14 à cette température. Ecrire la réaction de solubilisation de Ni(OH)2. Ni(OH)2 (s) = Ni2+aq + 2HO-aq. Calculer la solubilité s de cet hydroxyde. s = [ Ni2+aq] ; la solution est électriquement neutre : 2 [ Ni2+aq] = [HO-aq]. [HO-aq] = 10-14 / 10-pH =10-14 / 10-9,2 =1,58 10-5 ~ 1,6 10-5mol/L ; s = 1,58 10-5 / 2 = 7,9 10-6 mol/L.
Oxydoréduction. Le principe de l'éthylotest est basé sur une réaction d'oxydoréduction. L'appareil contient un tube de verre rempli de dichromate de potassium solide ( K2Cr2O7) acidifié. Lorsqu'une personne a consommé de l'alcool, de l'éthanol passe de son sang dans l'air de ses poumons. Si elle souffle dans un éthylotest, l'éthanol contenu dans son haleine sera oxydé en acide éthanoïque par les ions dichromates, de couleur orange, qui se transformeront alors en ion chrome (III) de couleur verte. Identifier les couples redox impliqués. Couples oxydant / réducteur : Cr2O72- /Cr3+ ; C2H4O2/C2H6O. Equilibrer les demi-équations de chaque couple. Ecrire la réaction globale. 2 fois { Cr2O72- + 14 H+ + 6 e- = 2 Cr3++7 H2O } 3 fois { CH3-CH2OH +H2O = CH3-COOH + 4e- + 4H+} 2 Cr2O72- + 16 H3O+ + 3 CH3-CH2OH = 4 Cr3++ 27 H2O + 3 CH3-COOH. Cinétique. Le formaldéhyde se forme dans l'atmosphère par la réaction entre l'éthylène et l'ozone suivant : 2O3(g) + 2C2H4(g) --> 4 HCHO (g) + O2(g).
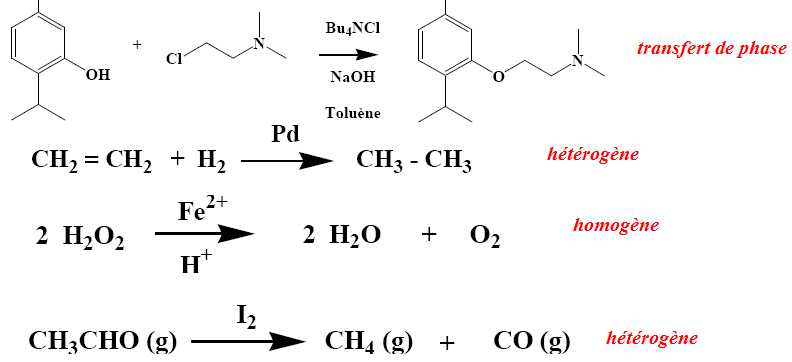
v0 = k [O3]0a[C2H4]0ß. Si [O3]0 triple, [C2H4]0 étant constant, la vitesse initiale triple : donc a = 1. Si [O3]0 double et si [C2H4]0 double, la vitesse initiale quadruple : donc ß = 1. Calculer l'ordre global de la réaction. a + ß = 1+1 = 2. Qu'est ce q'un catalyseur ? Un catalyseur augmente la vitesse d'une réaction lente, thermodynamiquement possible. Il est régénéré en fin de réaction et n'apparaît pas dans le bilan. Quand deux issues sont possibles, il peut orienter la réaction chimique. Préciser la différence entre les mécanismes de catalyse homogène et hétérogène. Catalyse homogène : le catalyseur est dans la même phase que les réactifs. Catalyse hétérogène : le catalyseur et les réactifs sont dans des phases différentes. Sur un catalyseur solide, un réactif gazeux peut s'adsorber à la surface du solide.
|
||||||||||||||||||||||||
|
|
||||||||||||||||||||||||