.
|
|
L'énergie lumineuse absorbée par une espèce colorée dépend de la
longueur d'onde utilisée. Un spectrophotomètre, une fois réglé, donne
une mesure de cette absorption par l'intermédiaire d'une grandeur
numérique sans dimension : l'absorbance. En générale l'absorbance est
proportionnelle à la concentration molaire volumique de l'absorbant : A
= kC. Un technicien veut suivre au spectrophotomètre la réaction en
milieu acide entre les ions MnO4- ( qui donnent à la solution une couleur violette ) et les molécules ( incolores) d'acide oxalique H2C2O4.
Il place dans le spectrophotomètre une cuve contenant V1 = 1,0 mL de permanganate de potassium de concentration C1 = 2,0 10-3 mol/L, V2 = 0,5 mL d'acide sulfurique de concentration C'2 = 0,5 mol/L et V3 = 1,0 mL d'eau. cette cuve est traverée par un faisceau lumineux adéquat.
L'appareil délivre la courbe (a) suivante représentant l'absorbance au cours du temps.
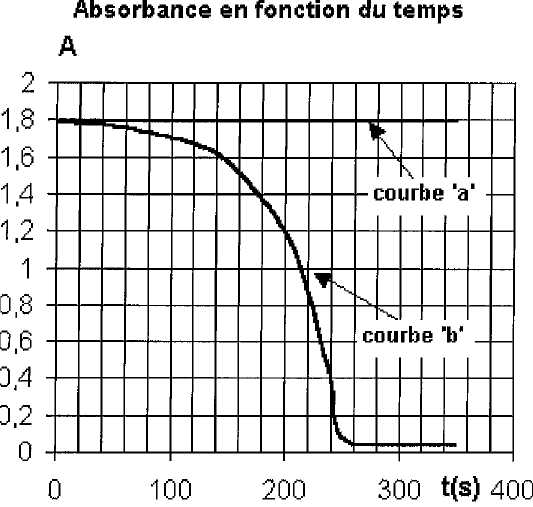
Qu'elle est l'espèce concernée par cette mesure ?
Il
s'agit de l'espèce présentant un maximum d'absorption à la longueur
d'onde utilisée : sans doute la seule espèce colorée, l'ion
permanganate.
|
| .
. |
.
Déterminer la valeur du coefficient k.
A = k [MnO4-] = k C1 ; k = A / C1= 1,8 / 2,0 10-3 = 9,0 102.
Il remplace lacuve par une autre contenant V1 = 1 mL de permanganate de potassium à C1 = 2,0 10-3 mol/L, V2 = 0,5 mL d'acide sulfurique à C2 = 0,5 mol/L et il ajoute V3 = 1,0 mL d'une solution d'acide oxalique à C3 = 5,0 10-3 mol/L. l'appareil trace alors la courbe b, représentative de l'évolution de la réaction totale d'équation bilan :
2 MnO4- + 5 H2C2O4 + 6 H3O+ ---> 2 Mn2+ + 10 CO2 + 14 H2O.
Quelle est l'espèce concernée par cette mesure ?
Il s'agit de l'espèce présentant un maximum
d'absorption à la longueur d'onde utilisée : sans doute la seule espèce
colorée, l'ion permanganate.
Qu'elle information donne le graphe b sur cette espèce ?
MnO4-
est l'un des réactifs qui disparaît au cours du temps : l'absorbance
finale étant quasiment nulle, l'ion permanganate est le réactif
limitant.
L'allure de la courbe laisse penser à une autocatalyse ( par l'ion manganèse (II) Mn2+).
Démontrer que l'acide oxalique est l'espèce réductrice.
Un réducteur s'oxyde en cédant des électrons :
H2C2O4 = 2CO2 + 2H+ +2 e-.
Etude cinétique de la réaction.
Donner la définition de la vitesse volumique v de la réaction à la date t.
v = 1/V dx/dt avec V : volume de la solution et x : avancement à la date t.
Etablir le tableau d'avancement volumique dans lequel on n'inscrira que les espèces MnO4-, H2C2O4, Mn2+.
| avancement
volumique (mol/L) | 2 MnO4- | + 5 H2C2O4 | ---> 2 Mn2+ | | initial | 0 | C1 = 2,0 10-3. | C3 = 5,0 10-3. | 0 | | en cours | x | 2,0 10-3-2x | 5,0 10-3-5x | 2x | | fin | xmax | 2,0 10-3-2xmax | 5,0 10-3-5xmax | 2xmax |
Exprimer la vitesse volumique de disparition des ions permanganate d[MnO4-] / dt en fonction de v.
d[MnO4-] / dt = d(2,0 10-3-2x)/dt = -2 dx/dt = -2 v.
Exprimer la vitesse volumique d'apparition des ions manganèse (II) d[Mn2+] / dt en fonction de v.
d[Mn2+] / dt = d(2x)/dt = 2 v.
Le spectrophotomètre calcule aussi la dérivée de l'absorbance et fournit la grandeur X définie par : X = -100 dA/dt.
Les valeurs de X exprimées en min-1 sont portées dans le tableau incomplet ci-dessous :| t(s) | 100 | 130 | 150 | 170 | 190 | 195 | 200 | | X ( min-1) | 9,7 | 13,4 |
| 37,4 | 53,9 | 63,0 | 75 |
Exprimer X en fonction de la vitesse v.
A = k [MnO4-] = k (2,0 10-3-2x) ; dA/dt = -2kdx/dt = -2k v ; X = -100 dA/dt = 200 k v.
Expliquer comment on peut évaluer numériquement X à une date donnée à partir de la courbe b et compléter la case vide du tableau.
Le coefficient directeur de la tangente à la courbe b à une date t, donne dA/dt.
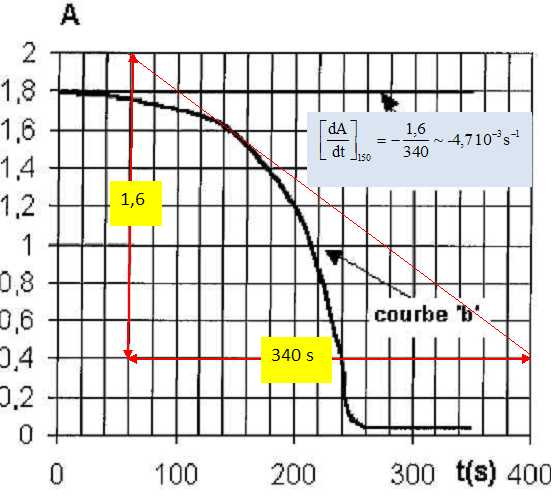
dA/dt = -4,7 10-3 *60 min-1 ~ -0,28 min-1. X = -100 dA/dt = 28 min-1.
|
Comment évolue la vitesse v au cours du temps ?
X et v sont proportionnelles : entre 0 et 200 s, la vitesse de la réaction est croissante.
l'un des produits de la réaction, l'ion manganèse (II), catalyse la réaction.
Quel est le rôle d'un catalyseur ?
Un
catalyseur accélère une réaction lente, thermodynamiquement possible.
Dans certains cas, il peut orienter la réaction lorsque deux issues
sont possibles.
Deux
paramètres antagonistes d'évolution de la vitesse v entre en compte.
L'un est la concentration en catalyseur ( dont l'augmentation
permet d'accélérer la réaction ).
Quel est l'autre ?
Les concentrations des réactifs dont la diminution entraîne la diminution de la vitesse de la réaction.
|

