|
|
On réalise un
mélange à partir d'un volume V1 = 10 mL d'une
solution aqueuse de chlorure de magnésium ( Mg2+aq
+ 2Cl-aq) de concentration en soluté apporté c1
= 0,10 mol/L et d'un volume V2 = 10 mL d'une
solution aqueuse de carbonate de sodium ( 2Na+aq
+ CO32-aq) de
concentration en soluté c2 = 0,10 mol/L.
on observe la précipitation du carbonate de magnésium MgCO3.
Mg2+aq
+ CO32-aq
= MgCO3(s).
On donne la constante de cette réaction à 25°C : K = 105.
A) La
concentration effective des ions magnésium et des ions
carbonate dans le mélange initial est la même. Vrai.
[Mg2+aq]=
[ CO32-aq] =0,10 mol/L.
B) L'expression
du quotient de la réaction de précipitation est Qr
= [Mg2+aq][CO32-aq]. Faux.
Qr
=1 / ( [Mg2+aq][CO32-aq] ).
C) Qr i
=400. Vrai.
Qr i
=1 / ( [Mg2+aq]i
[CO32-aq]i
) avec [Mg2+aq]i
=[CO32-aq]i
=0,10 / 2 = 0,05 mol/L ;
Qr i
=1 / 0,052 =400.
D) [CO32-aq]éq
= 0,050 mol/L. Faux.
Qr i
=1 / ( [Mg2+aq]éq
[CO32-aq]éq
) avec n(Mg2+aq)i
=n(CO32-aq)i
=V1c1 = 1,0
mmol ;
n(Mg2+aq)éq
=n(CO32-aq)éq
=1-xéq
; [Mg2+aq]éq
=[CO32-aq]éq
) = (1-xéq)/20 mol/L ;
1/((1-xéq)/20)2
= 105 ; (1-xéq)/20) ~3,2 10-3
mol/L.
|
| .
. |
Une lame de plomb de masse 100,0 g est à demi immergée dans une solution aqueuse de sulfate de plomb ( Pb2+aq + SO42-aq). Une lame de cuivre de masse 100,0 g est à demi immergée dans une solution aqueuse de sulfate de cuivre ( Cu2+aq + SO42-aq).
Les demi-piles ainsi constituées sont reliées par un pont
électrolytique contenant une solution aqueuse de nitrate de potassium (
K+aq + NO3-aq). On réalise le circuit
ci-dessous. L'ampèremètre indique que le courant circule du cuivre vers
le plomb dans le circuit extérieur.
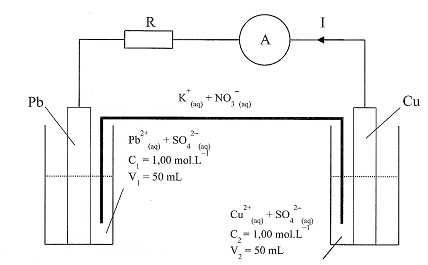 Couples redox intervenant dans la pile Cu2+aq/Cu(s) ; Pb2+aq /Pb(s) ; 1 F ~1,0 105 C mol-1.
A) La lame de cuivre constitue la borne négative. Faux.
Dans le circuit extérieur, le courant part de la borne positive de la pile, la lame de cuivre.
B) Le plomb est oxydé. Vrai.
Pb(s) = Pb2+aq + 2e-.
C) Le réactif limitant est l'ion plomb.
Faux.
Pb(s) + Cu2+aq=Pb2+aq +Cu(s) ; n(Pb) = 100 / M(Pb) = 50 / 207,2 ~0,24 mol ; n(Cu2+aq) = C2V2 =1,00 *0,050 = 0,050 mol (réactif limitant) ;
l'ion plomb (II) est l'un des produits et non pas l'un des réactifs.
D) La quantité maximale débitée par la pile est Qmax = 1,0 104 C. Vrai.
Réduction des ions cuivre (II) à la cathode positive : Cu2+aq + 2e- = Cu(s) ; n(e-) = 2 n(Cu2+aq) = 0,10 mol ; Qmax = Fn(e-).
On
dépose une couche de chrome sur un tube d'acier pour le protéger de
l'oxydation. La masse du dépôt de chrome est m = 1,04 g. M(Cr) = 52
g/mol. le dépôt est ralisé par électrolyse d'une solution de sulfate de
chrome (III) dans laquelle on fait passer un courant d'intensité
constante I = 10 A. Couple redox Cr3+aq/Cr ; 1 F = 1,0 105 C mol-1.
A) Le dépôt de chrome s'effectue à l'anode. Faux.
Réduction de l'ion chrome (III) à la cathode négative Cr3+aq + 3e- = Cr(s).
B)
Dans l'état final, la quantité de matière de chrome déposé est nCr = 0,020 mol. Vrai.
m/M(Cr) =1,04 / 52 = 0,020 mol.
C) La charge ayant circulé pendant l'électrolyse est Q = FnCr. Faux.
Q = Fn(e-) avec n(e-)= 3 nCr.
D) La durée de l'électrolyse est d'environ 200 s. Faux.
Q = I t = 3*0,020 *105 ; t = 6 *103 / 10 =600 s.
On
réalise l'életrolyse, entre deux électrodes inattaquables de graphite,
de 200 mL d'une solution aqueuse d'acide iodhydrique ( H3O+aq + I-aq) de concentration c = 0,050 mol/L. Cet acide est totalement ionisé dans l'eau.
On
observe à une électrode un dégagement d'un gaz qui déclenche une légère
détonation à l'approche d'une flamme et à l'autre électode l'apparition
d'un coloration jaune.
Couples redox intervenant dans l'électrolyse : O2(g) / H2O(l) ; H3O+aq / H2(g) ; I2aq / I-aq ; log 3,2 ~ 0,50.
A) L'équation de la réaction s'écrit 2H3O+aq +2I-aq = I2aq+ H2(g) +2H2O(l). Vrai.
Le gaz qui détonne est le dihydrogène et la coloration jaune est due au diiode.
B)
Le dégagement gazeux s'effectue à l'anode. Faux.
Réduction à la cathode négative : 2H3O+aq + 2e- = H2(g) +2H2O(l).
Cette électrolyse dure 30 min sous un courant d'intensité constante 0,20 A.
C) La quantité de matière d'électrons échangés est égale à environ 1,8 mmol. Faux.
Q =It = Fn(e-) avec n(e-)= It / F = 0,20 *30*60 / 105 =3,6 10-3 mol = 3,6 mmol.
D) A la fin de l'électrolyse, le pH final de la solution est d'environ 1,5. Vrai.
n(H3O+aq) consommés = n(e-)= 3,6 mmol ; n(H3O+aq) initial = 0,05 *200 =10 mmol ; n(H3O+aq) restant : 10-3,6 = 6,4 mmol dans 200 mL ;
[H3O+aq]final =6,4 / 200 =3,2 10-2 mol/L ; pH = - log(3,2 10-2) ~ -0,50 +2 ~1,5.
|
|
