|
L'ammoniac, dosage de l'acide acétique : concours technicien chimiste Strasbourg 2011. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||
|
NH3(g) + H2O(l) = NH4+aq + HO-aq. pKa ( NH4+/NH3 ) = 9,24 à 25°C. L'ion ammonium est un acide faible ; l'ammoniac est une bae faible dans l'eau. Déterminer une relation simple entre les concentrations molaires des ions ammonium et hydroxyde. La solution contient les ions : NH4+aq, HO-aq et H3O+aq. La solution étantt basique, H3O+aq est négligeable devant les autres ions. La solution étant électriquement neutre : [NH4+aq]=[HO-aq]. Donner l'expression de la conductivité s de la solution. s = lNH4+[NH4+aq] +lHO-[HO-aq] = ( lNH4++ lHO-) [NH4+aq]. On donne à 25°C : s = 10,9 10-3 S m-1 ; lNH4+=7,4 10-3 S m2 mol-1 ; lHO-= 19,8 10-3 S m2 mol-1. Calculer [HO-aq] et [NH4+aq] [HO-aq] =[NH4+aq] = s /( lNH4++ lHO-)= 10,9 10-3 / ( 7,4 10-3 + 19,8 10-3) = 0,400 mol m-3 = 4,0 10-4 mol/L. Calculer [H3O+] et [NH3]. On donne la concentration en soluté apporté c = 0,010 mol/L. [H3O+] = 10-14 / [HO-aq] = 10-14 / 4,0 10-4 =2,5 10-11 mol/L. Conservatio de l'élément azote : [NH3aq] + [NH4+aq] = c ; [NH3aq] = 0,010 -4,0 10-4 = 9,6 10-3 mol/L. Donner l'expression de la constante d'acidité du couple ion ammonium / ammoniac ; en déduire sa valeur et comparer à la valeur donnée. Ka = [H3O+aq] [NH3aq] /[NH4+aq] =2,5 10-11 * 9,6 10-3 / 4,0 10-4 = 6,0 10-10. pKa = - log (6,0 10-10) =9,22, en accord avec la valeur donnée. Ecart relatif : (9,24-9,22)*100 / 9,23 ~0,2 %.
Dosage de l'acide éthanoïque ( acétique ). Dans un volume VA = 20 mL de solution d'acide acétique de concentration cA = 0,01 mol/L et de pKa = 4,8, on verse progressivement une solution de soude de concentration cB = 0,02 mol/L. On donne les variations du pH en fonction du volume.
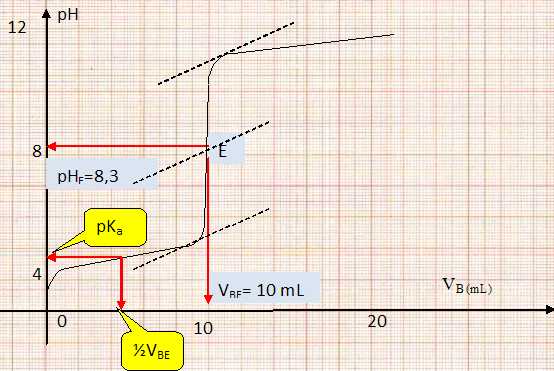 Ecrire les la relation entre les concentrations et les volumes des réactifs à l'équivalence. En déduire le volume VBE de soude versé à l'équivalence. VACA=CBVBE ; VBE = VACA/ CB = 20 *0,01 / 0,02 = 10 mL. Déterminer graphiquement le pH du point équivalent E. Justifier la méthode utilisée. La méthode des tangentes permet de déterminer les coordonnées du point équivalent. Vérifier que pour le volume àla demi-équivalence on a bien l'égalité pH = pKa. ( voir graphe ). Proposer des indicateurs colorés permettant de réaliser ce dosage. Le pH du point équivalent doit appartenir à la zone de virage de l'indicateur coloré. Phénolphtaléïne [8,0 ; 10 ] ; rouge de crésol [ 7,0 ; 9,0 ].
|
|||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||