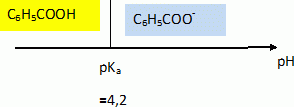.
|
|
Dosage
des ions chlorure par conductimétrie.
Dans un becher, on verse un volume V0 = 200,0 mL
d'une solution aqueuse de chlorure de potassium de concentration
molaire en soluté apporté c0. On immerge dans
cette solution, la cellule d'un conductimètre qui mesure la
conductivité s de
la solution. On lit s0
= 4,0 10-2 S m-1 à la
température ambiante.
Dans le volume V0 de la solution aqueuse de
chlorure de potassium, on ajoute goutte à goutte une solution aqueuse
de nitrate d'argent de concentration molaire en soluté
apporté c1 = 0,080 mol/L.
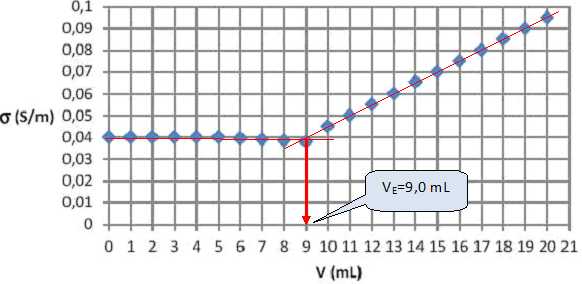
On note la valeur de la conductivité s en fonction du
volume V de solution de nitrate d'argent ajouté et on représente
graphiquement s
en fonction du volume V.
Ecrire
l'équation du dosage.
a) Le son ne se
propage pas dans le vide. Vrai.
Ag+aq
+Cl-aq ---> AgCl(s).
Calculer
la constante d'équilibre de cette réaction et vérifier qu'elle peut
bien servir de réaction de type dosage. On donne pKs
(AgCl)=9,7.
K = 1 / ([Ag+aq] [Cl-aq])
= 1/Ks = 1/10-9,7 = 109,7
==
5,0 109.
K est grand : la réaction est totale ;
de plus la transformation est rapide.
Cette réaction peut donc servir de support d'un dosage.
Donner
la définition de l'équivalence d'un titrage.
A l'équivalence, les quantités de matière des réactifs sont
en proportions stoechiométriques. Avant l'équivalence, dans le becher,
les ions chlorure sont en excès, après l'équivalence, les ions argent
sont en excès.
Justifier
l'allure de la courbe avant l'équivalence et après l'équivalence. Calculer c0.
| état |
avancement(mo) |
Ag+aq |
Cl-aq |
-->
AgCl(s) |
| initial |
0 |
n1
= C1VE |
n0
= C0V0 |
0 |
| en
cours |
x |
C1VE-x |
C0V0-x |
x |
| équivalence |
xéq |
C1VE-xéq =0 |
C0V0-xéq=0 |
xéq |
A l'équivalence
: C1VE
= C0V0.
C0= C1VE
/ V0 =0,080*9 ,0 / 200 =3,6 10-3
mol /L =
3,6 mol m-3.
Avant l'équivalence
: l'ion argent est en défaut. Le volume de la solution est à
peu près constant proche de V0.
s
= lCl-
[Cl-aq]+ lNO3-[NO3-]
+lK+[K+aq]
s = lCl-
(C0V0-x)/V0 + lNO3- x /V0 + lK+C0.
s = lCl- C0-x lCl-/V0 +x lNO3-/V0 + lK+C0.
s
=( lCl-
+ lK+)C0 + ( lNO3-
- lCl-) x / V0 = s0+ ( lNO3-
- lCl-) x / V0.
lNO3- =7,14
10-3 S m2 mol-1
; lCl-=7,63 10-3 S m2
mol-1 ;
lNO3- - lCl-)= -4,9 10-4
S m2 mol-1 .
s = 4,0
10-2 -
4,9 10-4 x / V0.
or x/V0 est inférieur à xéq/ V0 =C0 =
3,6 mol m-3 ;
4,9 10-4 x / V0 est
inférieur à 4,9
10-4
*3,6 ~1,8 10-3
S m-1.
La conductivité de la solution diminue donc très lentement et
reste très proche de sa valeur initiale.
|
| .
. |
Après l'équivalence
: l'ion chlorure est en défaut.
s = lAg+
[Ag+aq]+ lNO3-[NO3-]
+lK+[K+aq]
s = lAg+ (x-C0V0)/V0 + lNO3- x /V0 + lK+C0.
s
= - lAg+ C0+x lAg+ /V0 +x lNO3-/V0 + lK+C0.
s
=( lK+- lAg+ )C0 + x /V0( lAg+ + lNO3- ).
La conductivité croît rapidement.
Solution
d'acide benzoïque.
On introduit une masse m0 d'acide benzoïque dans
de l'eau distillée afin d'obtenir un volume V0 =
100 mL de solution. Après dissolution totale, on obtient une solution
aqueuse d'acide benzoïque notée S0 de
concentration C0 = 1,0.10-2
mol.L-1. Données : pKa( C6H5COOH/
C6H5COO-)
= 4,2. Solubilité dans l'eau de l'acide benzoïque : 2,4g.L-1
à 25°C.
Quelle
masse m0 faut-il
peser pour préparer la solution S0 ? La
solution est-elle saturée ?
Quantité de matière de soluté : n =V0C0
=0,10*1,0.10-2 = 1,0 10-3
mol. M(C6H5COOH) =122
g/mol.
m0 = n M(C6H5COOH)
= 1,0 10-3 *122 = 0,12 g dans 0,1 L soit 1,2 g/L.
Cette valeur étant inférieure à la solubilité, la solution n'est pas
saturée.
Le pH de la solution S0 est de 3,1.
Ecrire
l'équation de la réaction de l'acide benzoïque dans l'eau.
C6H5COOHaq +H2O(l)
=C6H5COO-
aq +H3O+aq.
Tracer
le diagramme de prédominance du couple acide benzoïque/ ion benzoate.
En déduire l'espèce prédominante dans la solution S0.
A pH inférieur à pKa, la forme acide C6H5COOHaq
prédomine.
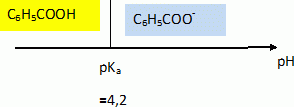
On ajoute à la solution S0 quelques gouttes
d'une solution concentrée de soude. Le pH mesuré est alors de 6,2.
Indiquer,
sans calcul, quelle(s) est(sont) la (les) espèce(s) prédominante(s)
dans la solution obtenue.
Espèces présentes : H3O+aq
; HO-aq ; Na+aq ; C6H5COOHaq ;
C6H5COO-
aq.
HO-aq négligeable devant H3O+aq
à pH < 7 à 25°C ; C6H5COOHaq
négligeable devant C6H5COO-
aq à pH > pKa.
Écrire
l'équation de la réaction qui se produit entre l'acide benzoïque et la
soude.
C6H5COOHaq + HO-aq
= C6H5COO-
aq +H2O(l).
Calculer
la constante K de cette réaction.
K = [C6H5COO-
aq] / ([C6H5COOHaq][HO-aq])
=[C6H5COO-
aq][H3O+aq] / ([C6H5COOHaq][HO-aq][H3O+aq])
K = Ka / Ke = 10-4,2
/ 10-14 = 1014-4,2 = 109,8
= 6,3 109.
Dilution
d'une solution concentrée.
Sur l'étiquette d'une bouteille commerciale d'acide formique concentré,
on relève les indications suivantes :
-poids moléculaire: 46,03 ; -densité: 1,22 ; -titre : 98%
Quel
volume d'acide formique concentré faut-il prélever pour préparer 1 L de
solution d'acide formique à c =0,1 mol.L-1
?
Masse de 1 L de solution : 1,22 kg = 1220 g ; masse d'acide pur :
1220*0,98 =1195,6 g ; concentration c0 = 1195,6
/ 46,03 =25,975 ~26,0 mol/L.
Facteur de dilution f = c0 / c =25,975/0,1 =
259,7 ~260. Volume à prélever : 1000 / 260 ~3,85 mL.
Décrire
le protocole ainsi que les consignes de sécurité à mettre en oeuvre
pour préparer la solution.
Port de blouse, gants et lunette de protection.
Prélever 3,9 mL de solution mère à l'aide d'une pipette graduée ou
d'une burette graduée ; verser dans une fiole jaugée de 1 L contenant
inittialement 1/3 d'eau distillée.
Compléter jusqu'au trait de jauge avec de l'eau distillée. Boucher et
agiter pour rendre homogène.
La
solution ainsi préparée a-t-elle une concentration de 0,1 mol.L-1
précisément ?
Non, il n'est pas facile de prélever avec précision 3,85 mL de solution
mère.
Comment
vérifier (éventuellement) la valeur exacte de cette concentration
?
Effectuer un titrage avec une solution de soude étalonnée.
|
|
|