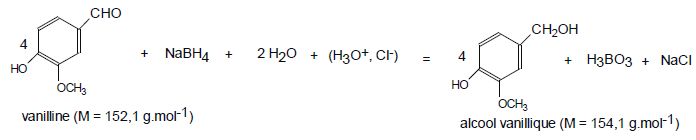|
Réduction de la fonction aldehyde de la vanilline : concours CAPLP maths sciences 2012. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||
|
.
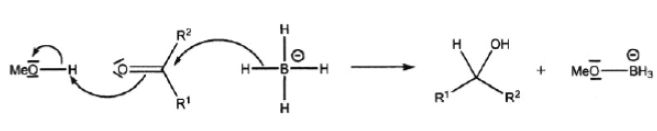
Utiliser un évaporateur rotatif. Quel est l’intérêt de l’ajout de l’acide chlorhydrique ? On donne les potentiels rédox suivants : E° (H+ / H2) = 0 V et E° (H2 / H-) = - 2 V. H+ apporté par l'acide, réduit l'excès d''ion hydrure. Calculer le pH de la solution d’acide chlorhydrique de concentration molaire 0,1 mol. L-1. pH = - log 0,1 = 1. Quel est l’intérêt de la solution saturée de chlorure de sodium ? La solubilité de l'alcool vanillique dans l'eau sera quasiment nulle en solution aqueuse saturée de chlorure de sodium Quel est l’intérêt du lavage ? Qu’observe-t-on lors de ce lavage ? Eliminer toute traces d'acide ( HCO3- est la base du couple (H2O, CO2 / HCO3-). On observe un léger dégagement de CO2. L’alcool vanillique brut peut être purifié par recristallisation dans l’éthanoate d’éthyle. Expliquer le principe d’une recristallisation. Le solide à purifier est dissout dans un solvant ou dans un mélange de plusieurs solvants chaud ; puis on refroidit la solution pour provoquer la cristallisation du solide que l’on isole par filtration. Quant aux impuretés, elles doivent êtres solubles dans le solvant à chaud comme à froid. Citer le matériel nécessaire pour une recristallisation. Dispositif de chauffage à refflux, dispositif de filtration simple, bain de glace-eau pour accélérer la cristallisation. Comment peut-on vérifier l’efficacité d’une recristallisation ? Mesure du point de fusion du solide sur un banc Kofler ou chromatographie CCM.
On donne le chromatogramme d’une CCM obtenu avec trois dépôts sur une plaque recouverte de gel de silice (avec indicateur de fluorescence). La plaque a été déposée dans une cuve contenant un mélange de cyclohexane/éthanoate d’éthyle en proportion volumique 50/50 puis a été révélée sous UV. Que signifie le sigle CCM ? Chromatographie sur couche mince. Qu’est ce que la fluorescence ? Propriété de certains atomes d'absorber certaines longueurs d'onde de la lumière et de la ré-emettre très rapidement. Donner la formule chimique de la silice. SiO2. Quel nom donne-t-on au mélange de solvant ici ? Phase mobile ou éluant. Quel est le nom du phénomène physique à l’origine de la montée du mélange solvant sur la plaque ? Le solvant monte le long de la plaque par capillarité. Identifier le produit contenu dans le dépôt A puis celui dans le dépôt C. 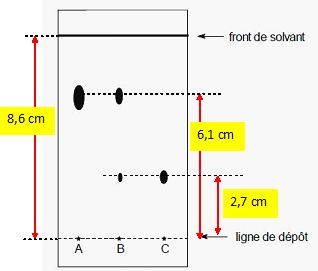 A : prélèvement du milieu réactionnel avant ajout de NaBH4. B : prélèvement du milieu réactionnel après ajout de NaBH4 et avant ajout de l’acide chlorhydrique C : solution du produit de réaction après recristallisation. Proposer une explication pour les positions relatives de ces produits sur le chromatogramme. La phase fixe, la silice est polaire. L'alcool vanillique est plus polaire que la vanilline. L'éluant est peu polaire. L'alcool vanillique a plus d'affinité pour la silice que la vanilline. Déduire à partir du chromatogramme du dépôt B si la réaction est terminée. Il reste encore de la vanilline ( réactif en défaut) : la réaction n'est pas terminée. Définir la grandeur notée Rf. Déterminer cette grandeur pour la vanilline et l’alcool vanillique. Distance parcourue par une espèce divisée par la distance parcourue par l'éluant. Rf(vanilline) =6,1 / 8,6 = 0,71 ; Rf(alcool vanillique) =2,7 / 8,6 = 0,31. Comment évolue la grandeur Rf quand on augmente la proportion d’éthanoate d’éthyle dans le mélange de solvant ? L'éthanoate d'éthyle est une molécule polaire : la polarité de l'éluant augmente. La vanilline et l'alcool vanillique étant polaires, leur affinité pour la phase mobile croît et les Rf vont augmenter.
|
||||||||||||||||||||||||||||||||||||
|
|