|
Le nickel de Raney : hydrogénation des alcènes : concours CAPLP maths sciences 2012. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
|
.
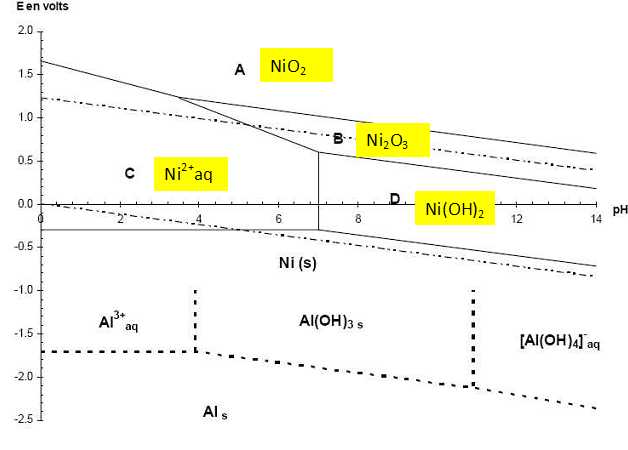
E = 0 + 0,03 log ([H+ (aq)]2) = 0,06 log [H+ (aq)] = -0,06 pH. E = 1,23 +0,03 log ([H+ (aq)]2 ). = 1,23 +0,06 log [H+ (aq)] = 1,23 -0,06 pH. Ecrire la demi équation redox relative au couple Ni(OH)2 (s) / Ni(s) puis l'équation de Nernst relative à ce couple. Déterminer le coefficient directeur de la droite frontière puis une méthode de tracé rapide pour les droites frontières de l'eau à partir du diagramme E-pH du nickel. Ni(s)+ 2HO-aq = Ni(OH)2 (s) + 2e-. E = E°(Ni(OH)2 (s) / Ni(s)) +0,03 log (1 / [HO-aq]2) = E°(Ni(OH)2 (s) / Ni(s)) +0,03 log ( [H+aq]2 / 10-28 ). E = E°(Ni(OH)2 (s) / Ni(s)) +0,06 log ( [H+aq] / 10-14 ) = E°(Ni(OH)2 (s) / Ni(s)) +0,06 log (1014 ) -0,06 pH. Pente de la droite frontière : -0,06. Les droites frontières de l'eau ont le même coefficient directeur que la droite frontière relative à Ni(OH)2 (s) / Ni(s). Ces droites sont parallèles : celle relative à H+ (aq) /H2(g) a une ordonnée à l'origine égale à zéro. Celle relative à O2(g)/H2O(l) a une ordonnée à l'origine égale à 1,23 V. On acidifie une solution contenant l'espèce B. Que se passe-t-il ? ( aucune équation n'est demandée ) Dismutation de B en Ni2+aq et NiO2(s). Ecrire l'équation de la réaction de formation de Al(OH)3 (s). Al3+aq + 3 HO-aq = Al(OH)3 (s). Ks = [Al3+aq] [HO-aq]3 = 10-32,3. Ecrire l'équation de la réaction de dissolution de Al(OH)3 (s). Al(OH)3 (s) + HO-aq = [Al(OH)4]- aq. Montrer que la constante d'équilibre K de la réaction de dissolution peut s'exprimer en fonction de la constante de solubilité Ks et de la constante de complexation globale ß4 de [Al(OH)4]- aq. Calculer sa valeur. Al3+aq + 4 HO-aq = [Al(OH)4]- aq. ß4 = [[Al(OH)4]- aq] / ([Al3+aq][HO-aq]4) =1033,4. K = [[Al(OH)4]- aq] / [HO-aq] = ß4 [Al3+aq][HO-aq]4/ [HO-aq] = ß4 [Al3+aq][HO-aq]3 = ß4 Ks = 1033,4 * 10-32,3= 12,6. Calculer le pH de fin de dissolution du précipité pour une solution d'ions aluminium Al3+aq de concentration c0 = 0,01 mol/L. K = [[Al(OH)4]- aq] / [HO-aq] = 12,6 ; [HO-aq] = [[Al(OH)4]- aq] / K = 0,01 / 12,6 =7,94 10-4 mol/L. pOH = - log (7,94 10-4) = 3,1 ; pH = 14 -pOH = 10,9. A partir des diagramme E-pH, expliquer la méthode de synthèse du nickel de Raney. Traiter un morceau d'alliage nickel-aluminium en poudre par la soude concentrée. La majeure partie de l'aluminium de l'alliage est dissous. La structure poreuse qui en résulte possède une importante surface spécifique. Vers pH 10, couples oxydant/réducteur : [Al(OH)4]- /Al(s) ; Ni(OH)2(s)/Ni(s) ; H2O/HO-. Al(s) et HO- appartiennent à des domaines disjoints. Les domaines relatifs à Ni(s) et HO- ont une partie commune. Les domaines relatifs à [Al(OH)4]- et HO- ont une partie commune. L'aluminium, réducteur le plus fort est oxydé. Le nickel de Raney est concervé dans l'eau, car il est pyrophorique quand il est sec. Que signifie pyrophorique ? Combustion spontanée en présence d'air.
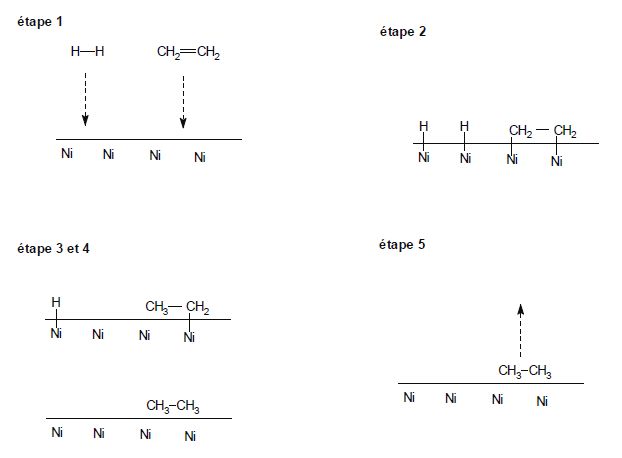
Hydrogénation des alcènes. L'hydrogénation d'un alcène A(g) par le dihydrogène est réalisée dans une enceinte fermée de volume V0 à T0 = 800 K à partir d'un mélange équimolaire d'alcène et de dihydrogène. On définit la vitesse de réaction de la manière suivante : A(g) + H2(g) = AH2(g). v = -dp(H2) /dt = -dp(A)/dt =dp(AH2) / dt où p est la pression partielle du gaz. Si on considère que la réaction possède un ordre, la vitesse de la réaction peut s'écrire avec a ( ordre partiel de A ), b ( ordre partiel de H2 ) et k la constante de vitesse : v = k pa(A) pb(H2). On mesure l'évolution de la pression partielle en dihydrogène en fonction du temps.
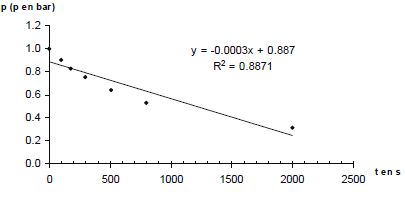
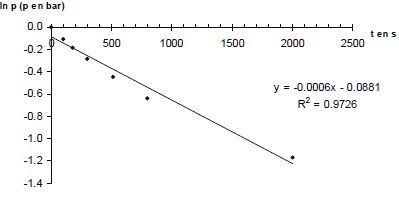
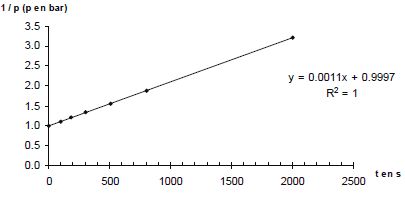
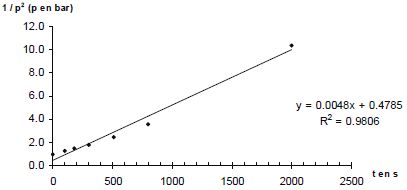
p = n RT0 / V0. Donner la relation entre p(A) et p(H2) à tout instant t. En déduire une équation différentielle vérifiée par p(H2). Le mélange initial étant équimolaire et les nombres stoechiométriques relatifs à A et H2 étant les mêmes, p(A) = p(H2). v = k p(H2)a+b ; v = -dp(H2) /dt ; dp(H2) /dt + k p(H2)a+b = 0. Si a+b = 1 : p(H2) = constante exp(-kt ) ou ln p(H2) = ln ( constante) -kt. Si a+b = 2 : p(H2) = B / t + C, B et C sont des constantes. A partir des différentes représentations des résultats expérimentaux, déterminer l'ordre global ( a+b) de la réaction. Pour chaque représentation, une régression linéaire a été effectuée : la droite a été tracée et son équation ainsi que le coefficient de corrélation donnés.
On a déterminer les temps de demi-réaction pour différentes hydrogénations de A en présence d'un excès de dihydrogène.
Le dihydrogène étant en excès, p(H2) peut être considérée comme constante et v = k' pa(A) a avec k' =k pb(H2). Le temps de demi-réaction étant indépendant de p(A), l'ordre partiel "a" est égal à 1. Par suite b = 1. Déterminer l'unité puis la valeur de la constante de vitesse k(800 K). 1/p = 0,0011 t +0,9997 du type 1/p = k t + 1/p0. k = 0,0011 bar-1 s-1.
|
||||||||||||||||||||||||||||||||||
|
|
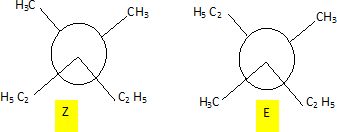
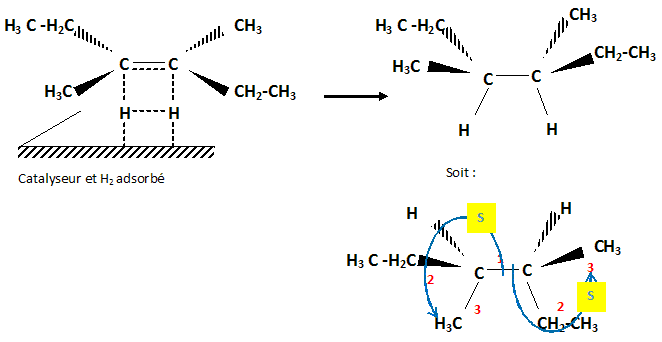
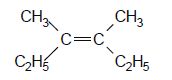 . Cette hydrogénation donne H2A.
. Cette hydrogénation donne H2A.