|
Chimie organique : diazométhane : concours Capes 2012. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
| .
. |
||||||
|
||||||
|
Proposer un
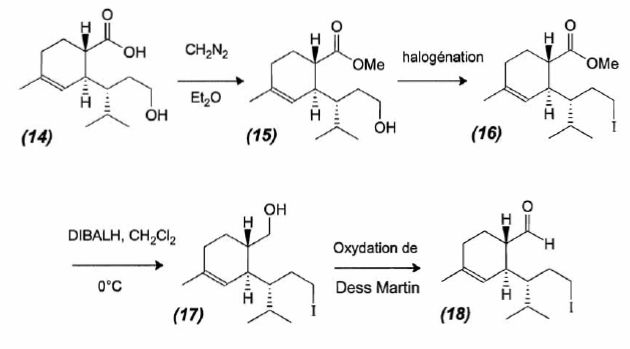
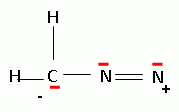
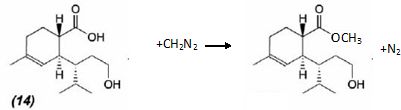
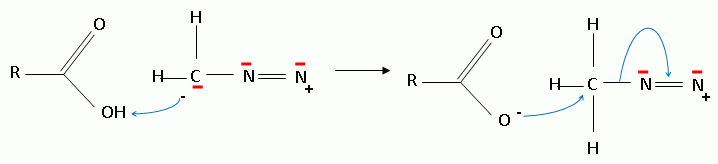
mécanisme pour la formation de (15). 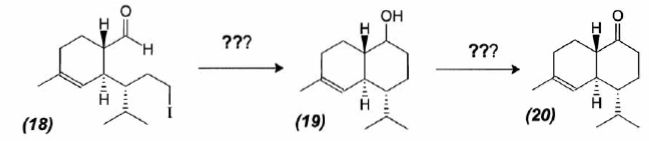 A partir du composé (18) comme seul réactif organique, des solvants et des réactifs inorganiques nécessaires, proposer une séquence réactionnelle ( réactifs, solvants, conditions opératoires ) permettant d'obtention du composé (19). Protonation du carbonyle en milieu acide, à température ambiante ou modérée, solvant dipolaire aprotique ( DMF ). Proposer un réactif permettant le passage de (19) à (20). Quel type de réaction réalise-t-on ? Oxydation ménagée d'un alcool secondaire en cétone par une solution diluée de dichromate de potassium. Le composé (20) est transformé en composé (21) : 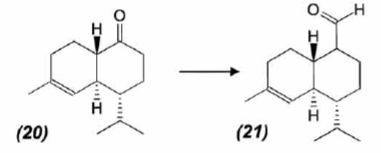 L'action du ter-butanolate de potassium (tBuOK) sur le composé (21) mène à un anion (22). Donner la formule topologique de cet anion et justifier sa stabilité. tBuO- est une base très encombrée favorisant une réaction d'élimination. L'atome d'hydrogène en alpha du carbonyle est acide. L'anion qui résulte de son départ est stabilisé par résonance. 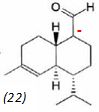 On ajoute à l'anion (22) le composé (23) dont la formule est donnée ci-dessous ; on isole un composé (24). 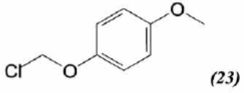 Donner la formule topologique de (24) ainsi que le mécanisme de sa formation. 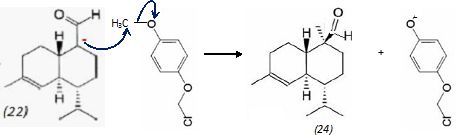 Citer un scientifique ayant participé à la découverte du benzène ou à la description de sa structure électronique. 1826 : découverte par Faraday ; 1866 : Kékulé propose deux formules équivalentes.
Après quatre étapes non détaillées, on obtient le composé (25) de formule brute C16H27NO qui subit une déshydratation pour donner le sesquiterpène (1) recherché de formule brute C16H25N. On donne le protocole opératoire : 6,3 mg du composé (25) sont dissous dans 2,5 mL de dichlorométhane, et l'ensemble est refroidi à 0°C sous atmosphère inerte. Un excès de POCl3 et de Et3N est ajouté au mélange réactionnel qui est agité 30 min. L'agitation est poursuivie une heure à température ambiante, puis le mélange est refroidi avec de l'eau froide et extrait à l'acétate d'éthyle. Les phases organiques sont réunies, lavées avec une solution de chlorure de sodium à 10 %, puis séchées. Après extraction du solvant à l'évaporateur rotatif, la purification de (1) par chromatographie sur colonne de silice ( éluant : acétate d'éthyle 99 ; éthanol : 1 ) donne 5,5 mg de (1) qui se présente sous l'aspect d'une huile de pouvoir rotatoire spécifique [a]D =+59,8. Calculer le rendement de cette étape. M(C16H27NO) =16*12+27+14+16 =249 g/mol ; n(24) = 6,3 / 249 = 0,0253 mmol ; on peut donc espérer obtenir au plus n(1) max =0,0253 mmol de (1). M(C16H25N) =16*12+25+14=231 g/mol ; n(1) réel = 5,5 / 231= 0,0238 mmol. Rendement : n(1) réel / n(1) max =0,0238 / 0,0253 = 0,94 ( 94 %).
|
||||||
|
|