Au
fond des océans ont été identifiés plusieurs dépôts métalliques tels
que les nodules polymétalliques ( riches en manganèse, nickel, cuivre
), les encroûtements cobaltifères, ou encore les dépôts alluvionnaires.
L'exploitation de ces gisements dépend essentiellement de la profondeur
à laquelle ils se trouvent. Les minéralisations de faible profondeur (
< 250 m ) font déja l'objet d'exploitations, celles des grandes
profondeurs ( > 1000 m ) commencent à attirer l'attention mais leur
exploitation pose encore beaucoup de problèmes en particuliers
environnementaux.
Certains minéraux sont extraits des roches continentales par l'érosion
et entraînés par les fleuves pour finir dans les océans sous forme de
"placers" ; un placer désigne un gisement de minerai de valeur (
diamant, pépite d'or, métaux rares ...) dans des sédiments alluviaux.
Ils sont exploités pour l'étain. Ainsi 50 % de la production d'étain de
la Thaïlande et de l'Indonésie provient de ces placers exploités par
des dragues offshores.
|
|
Structure de
l'étain.
A
quel grand scientifique peut-on attribuer la classification périodique
telle qu'on la cannaît aujourd'hui ? Quelle fut l'originalité de sa
démarche ?
Mendeleïev
range les 63 éléments connus à son époque selon leur masse atomique
croissante : il apparaît ainsi une périodicité concernant leurs
propriétés. Il laisse certaines cases vides ( éléments encore
inconnus ) tout en prédisant les propriétés de ces éléments manquants
grâce à celles de leurs voisins.
Donner
la configuration électronique de l'étain dans son état fondamental.
Quel élément de la seconde période se situe dans la même colonne que
l'étain ?
1s2 2s2 2p6 3s2 3p6
3d10 4s2
4p6 4d10 5s2 5p2.
Le silicium se situe dans la colonne de l'étain.
L'étain pur possède deux variétés allotropiques, l'étain blanc ( Snß
) stable pour des températures supérieures à 13°C et l'étain gris ( Sna ) stable pour des
températures inférieures.
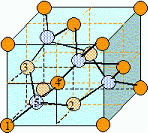
Décrire la maillde
de l'étain a, sachant que sa
structure est similaire à celle du diamant.
Les valeurs des masses volumiques de l'étain
gris et de l'étain blanc sont respectivement égales à ra =5,75 g cm-3 et
rß=7,28
g cm-3. Par grand froid ( températures proches de -50°C ),
un phénomène appelé " peste de l'étain ", rend l'étain pulvérulent. Interpréter ce
phénomène.
Par grand froid, l'étain
blanc se transforme rapidement en étain gris. Cette transformation
rapide ainsi que le changement de densité qui l'accompagne modifie la
tenue mécanique du solide.
Pour l'étain a, quel est le nombre
d'atomes d'étain par maille ?
La structure de type diamant est
une maille cubique à
face centrée avec occupation de la moitié des sites tétraèdriques ( 4
sur 8) de façon alternée, ce qui donne finalement 8 atomes par maille
élémentaire.
|
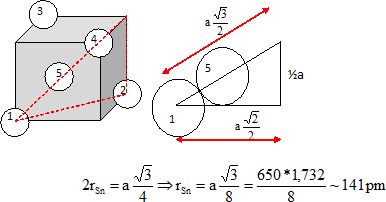
Vérifier que le
paramètre de la maille d'étain a
vaut a ~650 pm.M(Sn) = 118,7 g/mol
Volume d'une maille V= a3 .
masse de 8 atomes d'étain : 8*118,7 10-3 / 6,02 1023
= 1,5774 10-24 kg
masse volumique : 1,5774 10-24 / a3
= 5,75 103 kg m-3
; a = (1,5774 10-24 / 5,75 103 )1/3 =
6,50 10-10 m = 650 pm.
En déduire rSn
le rayon atomique de l'étain. Les atomes sont assimilés à des
sphères dures.
 . .
Calculer la
compacité de l'étain gris.
Compacité = volume des atomes / volume de la maille =8
*4/3 p rSn3
/ a3 =32/3 *3,14 *(141 / 650)3 = 0,34.
Le minerai.
Après
extraction, le minerai est partiellement débarassé de sa gangue et on
obtient un concentré contenant 75 % d'étain en masse. L'étain s'y
trouve sous forme de cassistérite SnO2.
Qu'est-ce
que la gangue ?
La gangue d'un minerai exploitable
correspond au minerai sans valeur qui l'accompagne et l'entoure.
Quel est le degré
d'oxydation de l'étain dans la cassistérite. + IV.
Quel pourcentage en
masse de cassistérite le concentré de minerai contient-il ?
75*(118,7+32) / 118,7 ~ 95 %.
Le système du
carbone et de ses oxydes.
. Ecrire les
équations des réactions de formation de l'oxydant à partir du réducteur
et d'une mole de dioxygène pour les couples suivants :
CO(g) / C(s) : 2C(s) + O2(g) = 2CO(g) (2)
CO2(g) / C(s) : C(s) + O2(g) = CO2(g) (1)
CO2(g) / CO(g) : 2CO(g) + O2(g) = 2CO2(g)
(3)
Pour
chacune de ces réactions, calculer l'enthalpie standard de réaction DrH° et l'entropie
standard de réaction DrS°
à 298 K.
|
CO2(g) |
CO(g) |
C(s) |
O2(g) |
CO2(aq) |
DfH° (kJ mol-1)
|
-393,5
|
-110,5
|
0
|
0
|
-413,8
|
S°
( J K-1 mol-1)
|
213
|
197,7
|
5,7
|
205,2
|
|
DrH02=2
DH0(CO)-2 DH0(C)-DH0(O2)=
2(-110,5)=-221 kJ mol-1.
DrH01=
DH0(CO2)-DH0(C)-DH0(O2)=
-393,5 kJ mol-1.
DrH03=
2DH0(CO2)-2DH0(CO)-DH0(O2)=
2(-393,5)-2(-110,5) =-566 kJ mol-1.
DrS02=2
S0(CO)-2 S0(C)-S0(O2)=
2*197,7-2*5,7-205,2= 178,8 JK-1 mol-1.
DrS01=S0(CO2)-
S0(C)-S0(O2)= 213-5,7-205,2= 2,1 JK-1
mol-1.
DrS03=2S0(CO2)-
2S0(CO)-S0(O2)= 2*213-2*197,7-205,2=
-174,6 JK-1 mol-1.
Donner la relation
liant l'enthalpie libre standard de réaction, l'enthalpie standard de
réaction, lentropie standard de réaction.
DrG0=DrH0-TDrS0.
A
quelle(s) condition(s) l'enthalpie libre standard est-elle une fonction
affine de la température T ?
DrH0
et DrS0doivent
être indépendants de la température.
Attribuer
à chaque droite du diagramme la réaction correspondante.
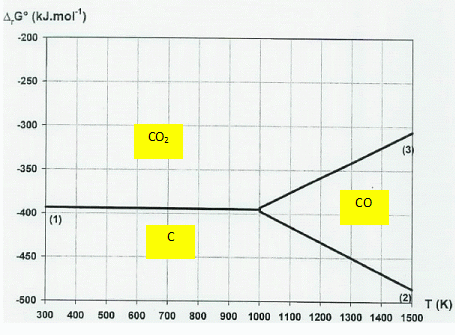
Montrer
sans calcul, en étudiant les positions relatives des différents tracés
qu'une des espèces n'a pas de domaine de prédominance dans un
intervalle de température que l'on précisera.
A une température comprise entre 300 K et 1000 K, CO(g) ne prédomine
pas.
Réduction de la
casistérite.
On
donne les équations des deux portions de droites d'Ellingham du couple
SnO2 / Sn ( ramené à une mole de dioxygène ) dans le domaine de
température [300 K - 1600 K ].
Entre 300 et 505 K : DrG04= -580,7+204,2 10-3T.
(kJ/mol)
Entre
505 et 1600 K : DrG05=
-587,8+218,3 10-3T.
(kJ/mol).
En déduire la valeur
de l'enthalpie standad de fusion de l'étain. Tfusion étain = 505 K.
DrH0fusion= -580,7 + 587,8 = 7,1 kJ mol-1.
Tracer les deux
portions de droites d'Ellingham du couple SnO2 / Sn.
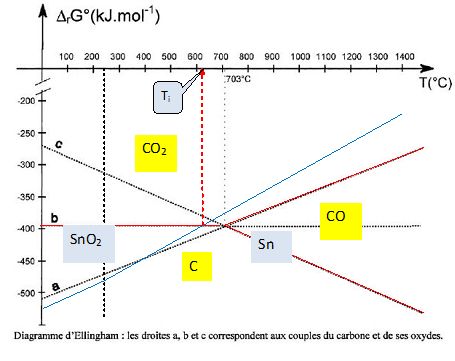
Calculer la
température d'intersection Ti entre le diagramme d'Ellingham
du couple SnO2 / Sn et celui des espèces carbonées.
Couple CO2(g)
/ C(s) : DrG01= -393,5-2,1
10-3T.
DrG02=DrG05 ; -587,8+218,3 10-3Ti = -393,5-2,1
10-3Ti.
Ti= (-393,5+587,8) / ((218,3+2,1) 10-3)
~ 882 K ou 609°C.
Quelles sont les
différentes réactions de réduction de SnO2 pouvant
intervenir dans le four ?
T < Ti : SnO2 (s) + C = Sn(l) + CO2(g).
T >703°C : SnO2
(s) + 2CO(g) = Sn(l) + 2CO2(g).
Que
représente Ti pour l'une de ces
réactions ? La température d'inversion.
La réaction s'effectue dans des fours à une température voisine de 1300
°C. Justifier
le choix de cette température.
L'étain est liquide ; la casistérite est solide jusquà 1630°C.
La vitesse de la réaction croît avec la température.
|
|
 .
.

