|
Le dioxygène et la vie marine : concours Capes 2012. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
| .
. |
||||||
|
||||||
|
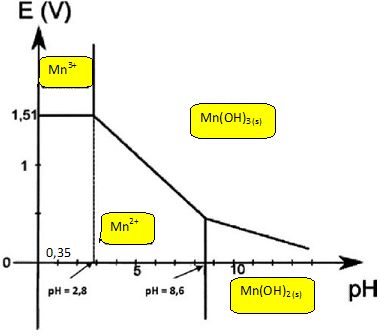
2H3O++2e- = H2(g) + 2H2O ; 3H2O =½O2(g) +2H3O++2e-. Donner pour chaque couple de l'eau, le potentiel d'électrode. E1 =E°(H3O+/ H2(g)) +0,03 log ([H3O+]2 / PH2) ; E1 = -0,06 pH -0,03 log PH2 = E1 = -0,06 pH si PH2= 1 bar. E2 =E°(O2(g)/ H2O) +0,03 log ( [H3O+]2 P½O2) ; E2 = 1,26-0,06 pH +0,03 log P½O2 E2 = 1,26-0,06 pH si PO2= 1 bar. Placer les deux droites frontières sur le diagramme précédent et discuter de la stabilité des espèces du manganèse dans l'eau en fonction du pH. 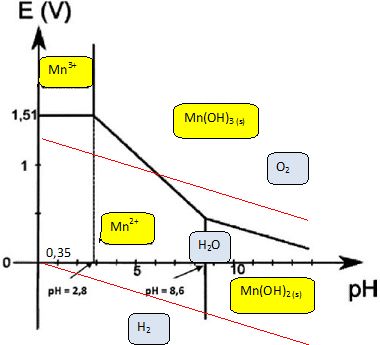 Mn2+, Mn(OH)2 appartiennent au domaine de stabilité de l'eau : ces deux espèces sont stables en solution aqueuses. A pH < 6, Mn3+, Mn(OH)3 ne font pas partie du domaine de stabilité de l'eau : ces deux espèces sont instables en solution aqueuses. A pH > 6, Mn(OH)3 appartient au domaine de stabilité de l'eau : cette espèce est stable.
Dosage du dioxygène dissous par la méthode de Winkler. On recueille V0 = 50,0 mL d'eau de mer dans un flacon presque rempli à ras bord. On ajoute rapidement 0,5 mL du réactif 1 ( solution de chlorure de manganèse II de concentration molaire environ 3 mol/L ) et 0,5 mL du réactif 2 ( solution d'iodure de potassium de concentration molaire environ 3 mol/L et d'hydroxyde de sodium de concentration molaire environ 8 mol/L ). On constate rapidement la formation d'un précipité blanc. Le mélange est agité pendant 3 heures. Un précipité brun est alors présent dans le flacon. Après ce délai, le flacon est rapidement débouché et l'échantillon est acidifié aux environ de pH =1,5 par addition d'acide sulfurique à 10 mol/L. On constate ladisparition rapide du précipité et l'apparition d'une belle couleur orangée. Les réactifs 1 et 2 sont très concentrés, ce qui permet d'affirmer qu'ils sont en très large excès. La totalité de la solution est titrée par une solution de thiosulfate de sodium ( 2Na+, S2O32-) de concentration molaire C1 = 5,0 10-3 mol/L. Ecrire l'équation de la réaction de formation du précipité blanc. Mn2+aq + 2HO-aq = Mn(OH)2 (s). Ce précipité est-il stable en présence de dioxygène ? Justifier à l'aide du diagramme E-pH. Mn(OH)2 (s) et O2 appartiennent à des domaines distincts : Mn(OH)2 (s) n'est pas stable en présence de O2. Ecrire l'équation de la réaction correspondant à la formation du précipité brun. Justifier que cette transformation soit lente. 2Mn(OH)2 (s) + ½O2 aq + H2O(l) = 2Mn(OH)3 (s). (0) " Le mélange est agité pendant 3 heures. Un précipité brun est alors présent dans le flacon" : la transformation est donc lente. Lors de l'ajout d'acide sulfurique, le précipité brun disparaît. Ecrire l'équation de la réaction de dissolution de ce précipité. Mn(OH)3 (s) + 3H3O+aq = Mn3+aq + 6H2O(l). (1) Donner l'équation de la réaction simultanée de formation du diiode. Mn3+aq +e- =Mn2+aq ; DrG°1 = - F E°(Mn3+aq /Mn2+aq ) =-96500*1,51. ½I2aq +e- =I-aq ; DrG°2 = - F E°(I2aq /I-aq ) =-96500*0,62. I-aq + Mn3+aq = ½I2aq +Mn2+aq. (2) K = [Mn2+aq][I2aq]½ / ([Mn3+aq][I-aq]). Calculer la constante d'équilibre thermodynamique de cette dernière réaction. DrG° = -RT ln K = DrG°1 -DrG°2 =-F(E°(Mn3+aq /Mn2+aq ) - E°(I2aq /I-aq )) =-96500*(1,51-0,62) = -8,59 104 J mol-1. ln K =8,59 104 /(8,31*298) =34,7 ; K = 1,15 1015. Aux 50 mL de la solution prélevés il est nécessaire d'ajouter un volume Veq de solution de thiosulfate de sodium pour observer l'équivalence. Ecrire l'équation support du titrage. Comment repère t-on l'équivalence ? I2aq +2S2O32-aq = 2I-aq +S4O62-aq.(3) En présence de diiode, l'empois d'amidon donne une teinte violet foncé. Etablir l'expression de la concentration molaire en dioxygène dissous dans l'eau de mer en fonction de Veq, V0 et C1. D'après (3) : n(I2aq) = ½n(S2O32-aq) ; d'après (2) n(I2aq) = ½n(Mn3+aq) ; d'après (1) n(Mn(OH)3 (s)) = n(Mn3+aq) ; d'après (0) n(O2 aq) = 0,25 n(Mn(OH)3 (s)) d'où : n(O2 aq) =0,25 n(S2O32-aq) = 0,25C1 Veq. [O2 aq] =0,25C1 Veq / V0.
|
||||||
|
|