|
L'océan, une pompe à CO2, solubilité des carbonates, alcalinité de l'eau de mer : concours Capes 2012. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
| .
. |
||||||
|
||||||
|
Définir la solubilité d'une espèce chimique. La solubilité d'une espèce chimique représente, à une température donnée, la quantité de matière maximale de cette espèce que l'on peut dissoudre par litre de solution. Dans l'eau de mer, des organismes microscopiques utilisent l'énergie du soleil pour transformer le CO2 en matière organique. Cette présence modifie-t-elle la solubilité du dioxyde de carbone gazeux ? Si oui, dans quel sens ? CO2(g) = CO2(aq). CO2(aq) étant comsommé en partie par ces organismes, sa concentration diminue : l'équilibre est déplacé dans le sens direct, dissolution du CO2(g). Justifier le terme "pompe biologique " à CO2. Le dioxyde de carbone entre dans la chaîne alimentaire (algues type diatomées) en suspension dans les eaux de surface. Ces algues consomment le dioxyde de carbone dissous par photosynthèse ; d'autres organismes marins fixent le carbone dans leurs coquilles calcaires. Le dioxyde de carbone possède des propriétés acides. Dans cette question, seules les propriétés acido-basiques du dioxyde de carbone sont prises en compte pour étudier l'influence du pH sur la solubilité du dioxyde de carbone dans l'eau à 298 K. Montrer que la solubilité du dioxyde de carbone peut se mettre sous la forme : s = A PCO2[1+B/[H3O+]+C/[H3O+]2]. K°1 = [CO2aq] / PCO2 ; Ka1 = [H3O+][HCO3-] / [CO2aq] ; Ka2 = [H3O+][CO32-] /[HCO3-]. [CO2aq] =K°1 PCO2 C°/ P°. s = [CO2aq] +[HCO3-] +[CO32-] =[CO2aq] (1+[HCO3-] / [CO2aq]+ [CO32-] / [CO2aq]). s = [CO2aq] (1 +Ka1 / [H3O+] + Ka1 Ka2/ [H3O+]2 ). s = K°1C°/ P° PCO2 (1 +Ka1 / [H3O+] + Ka1 Ka2/ [H3O+]2 ). Tracer le diagramme de prédominance acido-basique relatif aux espèces CO2aq, HCO3- aq et CO32- aq. On considère que le seuil de prédominance est de 10 %. CO2aq domine à pH < pKa1-1 ( soit 5,4) ; CO32- aq domine à pH > pKa2+1 ( soit 11,3) ; HCO3- aq domine dans l'intervalle de pH : [7,4 ; 9,3]. 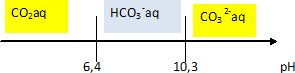 Etablir dans chaque domaine de prédominance, l'expression de log s. Tracer l'allure de la courbe log s = f(pH). pH<5,4 : s ~ [CO2aq] = K°1C°/ P° PCO2. log s ~log (K°1C°/ P° PCO2). 7,4 < pH< 9,3 : s ~[HCO3-] ~K°1C°/ P° PCO2 Ka1 / [H3O+] ; log s ~log (K°1C°/ P° PCO2 Ka1 ) +pH. pH > 11,3 : s ~[CO32-] = K°1C°/ P° PCO2 Ka1 Ka2/ [H3O+]2. s ~ log (K°1C°/ P° PCO2 Ka1 Ka2) +2pH. 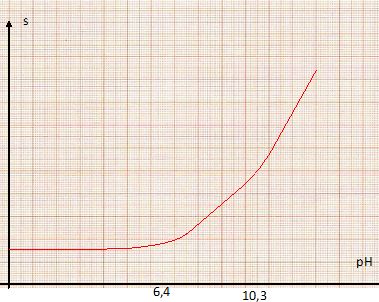 En milieu très basique ( pH > 10,3 ), la solubilité du dioxyde de carbone est la plus grande.
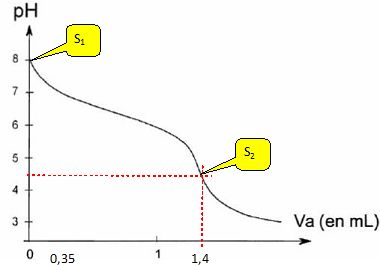
Influence du dioxyde de carbone sur la solubilité des carbonates. Pour mettre en évidence un dégagement de dioxyde de carbone, on utilise de l'eau de chaux. On constate l'apparition d'un précipité de carbonate de calcium. En présence d'un excès de CO2 ce précipité disparaît. Qu'est- ce que l'eau de chaux ? Le lait de chaux est obtenu en mélangeant dans un bécher un peu de chaux éteinte ( solide blanc) avec 100 mL d'eau. Laisser décanter ; filtrer : le filtrat obtenu est l'eau de chaux. Ecrire la réaction, notée (2), modélisant la dissolution du carbonate da calcium CaCO3(s) en présence d'un excès de CO2 aq . CaCO3(s)+ CO2aq +H2O= Ca2+aq +2HCO3-aq. Exprimer, en fonction du produit de solubilité Ks du carbonate de calcium et des constantes d'acidité de l'acide carbonique Ka1, Ka2, la constante d'équilibre K°2 de cette réaction, puis la calculer à 298 K. Ks = [Ca2+aq][CO32-aq] ; Ka1 = [H3O+][HCO3-] / [CO2aq] ; Ka2 = [H3O+][CO32-] /[HCO3-]. K°2 = [HCO3-aq]2[Ca2+aq] / [CO2aq]. Ka1 / Ka2 = [HCO3-]2 / ([CO2aq][CO32-]). K°2 =Ka1 / Ka2 [CO32-][Ca2+aq] = Ka1 Ks / Ka2 . K°2 = 10-6,3 *10-8,3 / 10-10,3 =10-4,3 =5,0 10-5. Certains organismes marins ont une coquille à base de carbonate de calcium. Quelle est la conséquence d'une augmentation du dioxyde de carbone dissous pour ces organismes marins ? Les coquilles seront plus minces et plus fragiles. Alcalinité totale de l'eau de mer. L'alcalinité totale de l'eau de mer est une donnée biogéochimique indépendante des variations de pH de l'eau de mer. Elle est définie comme la balance des charges des ions dont la concentration varie avec le pH. Modélisons l'eau de mer comme une solution contenant les espèces suivantes : Na+, Cl-, H3O+, HO-, CO32-, HCO3- et CO2 aq. L'alcalinité totale AT de cette eau se définit comme étant : AT = [HCO3-] +2[CO32-] +[HO-]-[H3O+]. A partir de l'équation d'électroneutralité relative à une telle solution, en déduire une expression de AT en fonction des concentrations molaires [Na+] et [Cl-]. [Na+] + [H3O+] = [Cl-] +[HCO3-] +2[CO32-] +[HO-] AT= [HCO3-] +2[CO32-] +[HO-]-[H3O+] = [Na+] - [Cl-]. On considère un litre de solution de chlorure de sodium de concentration molaire C1 =0,7 mol/L dans lequel on introduit 2,0 10-3 mol de CO2aq. On appelle S0 la solution obtenue. Calculer le pH de cette solution. Conservation de l'élément carbone : 2,0 10-3 =[CO2 aq] +[HCO3-] +[CO32-] = [CO2 aq]( 1 +[HCO3-]/ [CO2 aq] +[CO32-] / [CO2 aq]) 2,0 10-3 = [CO2 aq]( 1 +Ka1/ [H3O+] +Ka1Ka2/ [H3O+]2). La solution est électriquement neutre : [Na+] + [H3O+] = [Cl-] +[HCO3-] +2[CO32-] +[HO-] ; [H3O+] = [HCO3-] +2[CO32-] +[HO-]. Hypothèse : CO2 aq majoritaire : Ka1 =[HCO3-][H3O+]/ [CO2 aq] et [H3O+] ~ [HCO3-]. Ka1 ~[H3O+]2/ [CO2 aq] ; 2,0 10-3 ~[CO2 aq]. Ka1 ~ [H3O+]2/2,0 10-3 ; [H3O+] = (2 10-3 Ka1)½ = (2 10-3 *10-6,3)½ =3,16 10-5. pH ~4,5. ( L'hypothèse est bien vérifiée ). Que vaut l'alcalinité totale ATS0 de la solution S0 ? ATS0 = [Na+]S0 - [Cl-]S0 = 0,7-0,7 = 0.
|
||||||
|
|
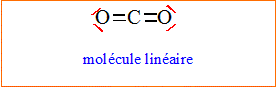 L'atome
de
carbone central est du type AX2.
L'atome
de
carbone central est du type AX2.