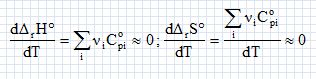|
Equilibre entre deux oxydes de cobalt : concours Agrégation interne 2011. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||
|
Par
chauffage du carbonate de cobalt, on obtient le monoxyde de cobalt CoO.
Si on porte CoO à haute température, il est converti en Co3O4.
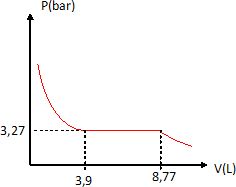
Définir puis calculer la variance du système à l'équilibre entre les deux oxydes et le dioxygène et conclure. La variance, notée v, d'un système physicochimique à l'équilibre est égale au nombre de variables intensives indépendantes que l'expérimentateur peut fixer. v = N-R+2-j. N = 3 constituants ; R = une relation entre les trois constituants ; 2 paramètres intensifs, température et presssion ; j : 3 phases. v = 3-1+2-3 = 1. Un seul paramètre intensif, température ou pression, peut être fixé par l'expérimentateur. L'état d'équibre du système est alors décrit. Un récipient de volume V0 = 10 L contient initialement n1 = 1,00 mol de monooxyde de cobalt CoO(s) , et n2 = 0,300 mol de dioxygène gazeux. Le récipient est maintenu à la température de 1150 K. Indiquer si le monooxyde de cobalt est oxydé dans les conditions initiales. Qr i = P°/PO2 ; PO2 =n2 RT / V0 =0,300 *8,314*1150 / 0,010 =2,87 105 Pa = 2,87 bar. Qr i = 1 / 2,87 = 0,35. Qr i > K°1, donc évolution du système dans le sens indirect, réduction de Co3O4(s). A la température constante T = 1150 K, le récipient subit une compression de volume jusqu'à atteindre un volume final VF = 1,00 L. Rechercher le domaine des valeurs du volume du récipient pour lequel l'oxydation du monooxyde de cobalt a lieu. Qr i < K°1, PO2 > Péq ; n2 RT / V > Péq ; V < n2 RT / Péq ; V < 0,300*8,314*1150 / (3,27 105 ) ; V < 8,77 10-3 m3 ; V < 8,77 L.
|
||||||||||||||||||||||||||||||||||||||
|
|