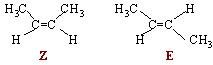|
|
Bien qu'en relative petite quantité, la caféine est un des constituants essentiels des boissons au cola.
Structure.
Justifier à l'aide de deux arguments simples que la caféine puisse être considérée comme un composé aromatique.
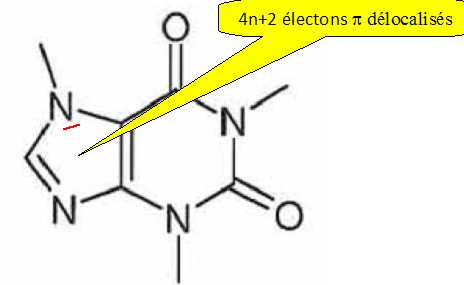
Une molécule sans atome de carbone asymétrique peut-elle être chirale ?
Oui : certains allènes, certains spiranes pevent être chiraux.
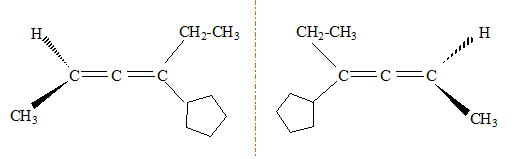
Une molécule possédant des atomes de carbone asymétrique peut-elle être achirale ?
Oui, s'il existe par exemple un centre de symétrie.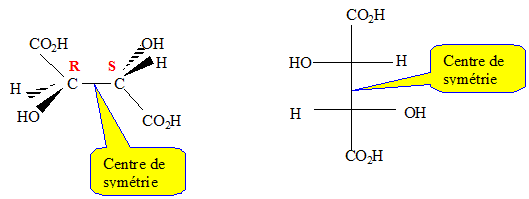
Une molécule ne possédabt pas d'atome de carbone asymétrique peut-elle avoir un diastéréoisomère ?
Oui, c'est le cas de l'isomérie Z E ou cis trans dans un cycle.
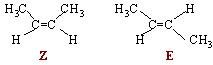
|
.
.
Obtention et extraction de la caféine.
Un verre de boisson contient 10 mg de caféine.
Au
cours d'un TPE, les élèves ont souhaité comparer le pouvoir excitant
attribué à la caféine entre du thé et leur boison au cola. Pour cela
ils ont cherché à extraire la caféine du thé en suivant le protocole
suivant :
Réaliser l'hydrodistillation de 3 sachets de thé.
Réaliser une double extraction à l'éthanoate d'éthyle du mélange obtenu.
Sécher la phase organique, filtrer sur un ballon taré. Evaporer le solvant.
Les élèves ont obtenu 0,12 g d'un produit légèrement huileux.
En supposant que le produit obtenu soit bien de la caféine, indiquer la réponse apportée à leur question initiale.
Un sachet de thé contient 120 / 3 = 40 mg de caféine, soit 4 fois plus qu'un verre de boisson au coca.
Comment sécher la phase organique ?
Agiter la phase organique contenue dans un erlenmeyer avec un sel anhydre, MgSO4 ou Na2SO4, solide pulvérulent.
On
observe un solide au fond de l'erlenmeyer et le liquide organique
se clarifie. Ajouter du solide anhydre en agitant jusqu'à ce que le
solide pulvérulent demeure au fond.
Indiquer par une ligne comment il est possible :
- d'évaporer le solvant. Utiliser un évaporateur rotatif.
- d'améliorer l'aspect final du produit. Effectuer une recristallisation.
-
de prouver simplement que les élèves ont bien obtenu de la caféine.
mesure de la température de fusion du produit recristallisé à l'aide
d'un banc Koffler et comparer avec la température de fusion de la
caféine.
La caféine est évidemment en relative grande quantité dans le café ; quelle technique est actuellement utilisée pour décaféiner ce dernier ?
On utilise le dioxyde de carbone à l'état supercritique.
Historiquement, contrairement à la vanilline, on s'est peu intéressé à des voies de synthèse de la caféine : qu'elle explication peut-on proposer ?
En décaféinant le café, on obtient suffisamment de caféine.
|
.
|