|
|
Peser
5,00 g de vanilline commerciale que l'on transvase quantitativement
dans une fiole jaugée de 500,0 mL ; solubiliser la vanilline et
compléter au trait de jauge à l'aide de soude à 0,100 mol/L.
Réaliser ensuite le titrage pH-métrique de V0 = 20,0 mL de la solution de vanilline par de l'acide sulfurique CH2SO4 = 0,100 mol/L.
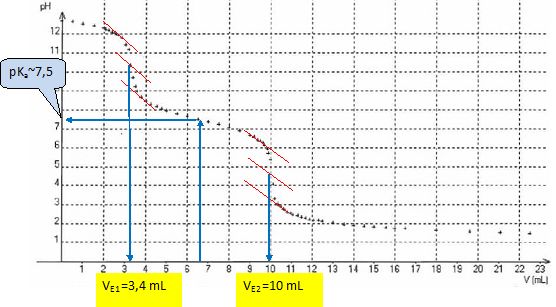
Déterminer la concentration Cva de la solution de vanilline. Calculer la pureté correspondant à ce résultat.
La première équivalence correspond au dosage des ions HO-. La seconde au dosage des ions vanillinate.
A la seconde équivalence : n(vanillinate) = V0 Cva= n(H+) = 2 nH2SO4 = 2CH2SO4(VE2-VE1).
Cva=2CH2SO4(VE2-VE1) / V0= 2*0,100 (10-3,4) / 20,0 = 0,066 mol/L.
Soit CvaM(vanilline) = 0,066*152 ~ 10,0 g/L ou 5,0 g dans 500 mL.
Par cette méthode, aucune impureté n'est détectée.
Estimer graphiquement le pKa de la vanilline. pKa ~7,5.
Les propriétés acido-basiques de la vanilline peuvent-elles influer sur le dosage de l'acide phosphorique ?
pKa (H2PO4- / HPO42-
= 7,2, valeur proche de celui de la vanilline : la vanilline et la
seconde acidité de l'acide phosphorique seront dosées simultanément. La
vanilline, si elle est en assez grande quantité, influence le dosage de
l'acide phosphorique.
Quelle quantité de vanilline dans la boisson étudiée ?
Lors d'un travail en TPE, un groupe d'élève a souhaité avoir une idée
de la quantité de vanilline présente dans la boisson étudiée. Ils ont
adaptés le protocole d'extraction et de dosage de la vanilline suivant :
Sous hotte, dans une ampoule à décanter, verser 50 mL de boisson
dégazée. Procéder à trois extractions successives de la phase aqueuse
avec des portions de 25 mL de dichlorométhane.
Rassembler les phases organiques et procéder à 3 extractions successives avec des portions de 50 mL de soude à 0,1 mol/L.
Transvaser la phase utile pour le dosage de la vanilline dans une fiole
jaugée de 200 mL. Compléter jusqu'au trait de jauge avec le même
solvant.
A partir de la solution de vanilline standard fournie de concentration
10 mg/L, préparer des solutions de concentration 8, 5, 4, 2 et 1 mg/L.
Régler le spectrophotomètre et déterminer la concentration de la
vanilline en mg/L dans la boisson. Le groupe a obtenu les résultat
suivant :
titre de la solution ( mg/L)
|
10
|
8
|
5
|
4
|
2
|
1
|
boisson
|
Absorbance A
|
1,859
|
1,507
|
0,912
|
0,714
|
0,347
|
0,167
|
1,083
|
|
.
Pratique expérimentale.
Pourquoi effectue-t-on les extractions en trois fois 25 mL plutôt qu'n une fois 75 mL ?
Pour
quantifier le bénéfice, on pourra prendre une constante de partage k =
7 pour la vanilline entre l'eau et le dichlorométhane.
Le coefficient de partage k ne dépend que de
la température et de la nature des solvants ; k est
le rapport des concentrations molaires d'une espèce
notée E dans deux phases aqueuse et organique non
miscibles :
k = [E]org /
[E]aq .
En utilisant une portion de volume Vorg= 75
mL, on obtient : k = norg Veau/ (
neau Vorg) avec norg
+ neau = constante = N.
Or Vorg=1,5 Veau il vient : norg =
1,5 k neau ; 1,5k neau + neau
=N.
neau =N/(1,5k+1) = 0,087 N et
norg = 1,5kN/(1,5k+1)= 0,913 N.
si k=7 alors 91 % de
l'epèce à extraire est dans la phase
organique.
En utilisant successivement trois portions de volume Vorg=25 mL, on obtient : (Or Vorg=0,5 Veau )
première extraction : k =
n1 org Veau/ (0,5
Veau n1 eau) = 2 n1
org / n1
eau avec n1 org + n1 eau = N.
n1 org= 0,5 k n1 eau ;
0,5 k n1 eau + n1 eau = N ;
n1 eau = 2N/(k+2) et
n1 org= kN/(k+2).
seconde extraction : k = 2 n2 org / n2 eau
avec n2 org + n2 eau = n1
eau.
n2 eau= 2/ k n2 org; 2/k n2 org + n2 org = n1 eau
; n2 org = (1+2/k) n1 eau =k
/(2+k)n1 eau ; n2
org = 2kN /(2+k)2.
n1 org+
n2 org =
kN/(k+2) + 2kN
/(2+k)2 =
kN/(k+2)
[1+2/(k+2)]=k(k+4)N/(k+2)2. norg
=k(k+4)N/(k+2)2.
norg= 7*11 N / 92 =0,95 N ; si k=7 alors 95 % de
l'epèce à extraire est dans la phase
organique.
troisième extraction : k = 2 n3 org / n3 eau
avec n3 org + n3 eau = n2
eau.
n3 eau= 2/ k n3 org; 2/k n3 org + n3 org = n2 eau
; n3 org = (1+2/k) n2 eau =k
/(2+k)n2 eau =k
/(2+k)2/ k n2 org =k
/(2+k) 2/ k 2kN
/(2+k)2 = n3
org = 4kN /(2+k)3.
n1 org+
n2 org +n3 org =
kN/(k+2) + 2kN
/(2+k)2 +4kN
/(2+k)3 =
kN/(k+2)
[1+2/(k+2)+4/(k+2)2]
norg= 7/9 N (1+2/9 +4/81) ~0,99 N ; si k=7 alors 99 % de
l'epèce à extraire est dans la phase
organique.
Indiquer
le rôle de l'extraction au dichlorométhane et celui de l'extraction à
la soude. Préciser le solvant avec lequel les élèves doivent compléter
la fiole jaugée.
Le dichlorométhane extrait la vanilline ( et les autres composés organiques présents) de la boisson ( phase aqueuse ).
La soude transforme la vanilline en ion vanillinate, soluble dans
l'eau. Les autres espèces organiques restent en phase organique. La
soude permet l'extraction de la vanilline de la phase organique.
La fiole jaugée est bien entendu complétée avec de la soude.
Rappeler
la loi de Beer-Lambert. Préciser le nom et l'unité de chacune des
grandeurs intervenant dans cette loi ainsi que ses conditions de
validité.
La loi de Berr-Lambert
exprime la variation de l'intensité lumineuse en
fonction de la distance parcourue dans un milieu
transparent.
Lorsqu'une lumière monochromatique
d'intensité I0 traverse un milieu
homogène, l'intensité de la lumière
émergente I décroît exponentiellement
lorsque l'épaisseur l du milieu absorbant
augmente.
I = I0 . e (-
al)
a est une constante appelée coefficient
d'absorption, caractéristique du milieu et de la
longueur d'onde considérés.
Dans le cas des solutions, la loi de Beer fait intervenir
les concentrations.
I = I0 . e (-
elc)
où e
est un coefficient caractéristique de la
substance appelé coefficient d'absorbance
(L mol-1
cm-1),
l est
l'épaisseur de la cuve
(cm) et
c la concentration de la solution
(mol/L).
Cette loi est vérifiée lorsque la solution
est de concentration inférieure à : c < 0,1
mol.L-1.
La relation fondamentale utilisée en
spectrophotométrie est présentée sous
la forme :
A= log (I0/I) =
elc
( A est
l'absorbance
ou densité
optique)
e
est une caractéristique de la
molécule. Plus e
sera grand, plus la solution absorbe.
Absorbance et concentration étant
proportionnelles, cette relation peut être
utilisée pour réaliser des dosages ou des
suivis cinétiques.
Quel pourcentage d'intensité lumineuse transmise correspond à la solution à 8 mg/ L ?
A= log (I0/I) ; I / I0 = exp(-A) =10-1,507 =0,031 ( 3,1 %).
Quelles opérations correspondent ici à l'expression " régler le spectrophotomètre" ?
Régler le zéro à l'aide de la solution de référence, ici la soude.
Tracer le spectre de la vanilline et retenir la longueur d'onde pour
laquelle l'absorbance est maximale : la précision sera meilleure.
Se placer sur cette longueur d'onde et faire le zéro à l'aide de la solution de référence.
Quelle longueur d'onde de travail peut-on choisir ?
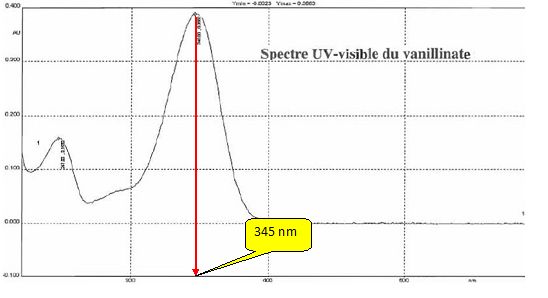
Quelle estimation de la concentration en vanilline ( mg/L) dans la boisson, les élèves peuvent-ils tirer de ces mesures ?
Une régression linéaire effectuée à partir des mesures expérimentales
donne : A = 0,190 C -0,0318 avec un coefficient de corrélation r =
0,9998.
La loi de Beer est bien vérifiée : C = (1,083 +0,0318) / 0,190 =5,87 mg/L.
Tenir compte du facteur de dilution lors des deux extraction F = 75/50 *200/75 =200/50 = 4.
Cboisson =4 C = 23,5~24 mg/L.
Proposer
deux idées d'expériences complémentaires pour aider les élèves à
valider leur protocole et évaluer la précision de leur estimation.
Faire une extraction supplémentaire de la phase aqueuse ; tracer le spectre afin d'identifier des traces de vanilline.
Mettre en oeuvre tout le protocole à partir d'une solution étalon à 24 mg/L de vanilline et comparer les résultats.
Utiliser ce résultat pour quantifier l'influence éventuelle de la vanilline sur le dosage acido-basique de l'acide phosphorique.
Quantité de matière de vanilline dans 100 mL de boisson ( volume
prélevé lors du dosage de l'acide phosphorique dans la boisson )
nva = 0,024 / M(vanilline )*0,1 =0,024/152*0,1 =1,6 10-5 mol.
n(soude à 0,05 mol/L )= 1,6 10-5 mol ; volume de soude correspondant : 1,6 10-5 /0,05 =3,1 10-4 L ou 0,3 mL ( 3 %).
|
.
|

