|
Hydrodistillation, entraînement à la vapeur, parfums à odeur florale : concours Agrégation interne 2011. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||
|
||||||||||||||||||
|
Les
huiles essentielles utilisées en parfumerie sont obtenues par
hydrodistillation ou entraînement à la vapeur d'eau d'une matère
première végétale. Ces huiles essentielles sont généralement
constituées d'un mélange de plusieurs composés. Pour limiter la
quantité de matière végétale utilisée, quand cela est possible, on
réalise des synthèses des composés présentant un intérêt olfactif.
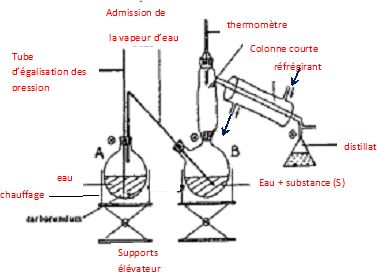
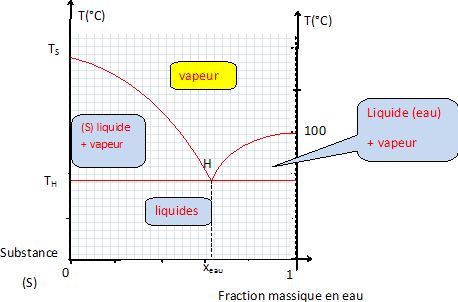
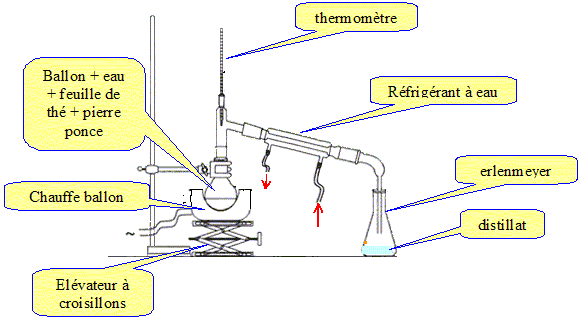
Hydrodistillation : on distille le mélange hétérogène eau + produit naturel ; on récupère un mélange eau + composé organique qui bien souvent surnage.
Entraînement à la vapeur : on injecte de la vapeur d'eau dans un liquide organique ; celui-ci est chauffé par la vapeur d'eau et distille avec elle : il est entraîné. Le corps à entraîner doit avoir une tension de vapeur non négligeable à la température d'entraînement. Cette méthode est intéressante si la température d'ébullition du corps organique est élevée. Pourquoi un montage de distillation fractionnée ne pourrait pas être utilisé à la place du montage d'hydrodistillation ? Les huiles essentielles contiennent des molécules ayant des températures d'ébullition souvent élevées. De plus ces molécules peuvent être détruites à température relativement élevée. Le montage de distillation fractionnée ne peut donc pas convenir. Par contre l'hydrodistillation ou l'entraînement à la vapeur d'eau maintient une température inférieure à 100 °C : les molécules à extraire ne risque pas d'être détruites.
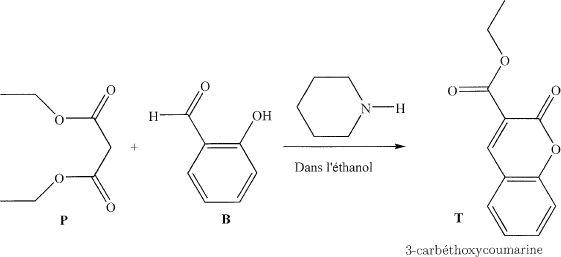
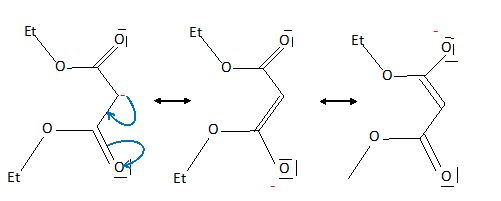
L'huile essentielle obtenue à partir du jasmin contient de la cis-jasmone représentée ci-après : 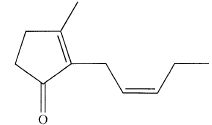 On propose une synthèse de la cis-jasmone. On traite la dicétone insaturée ci-dessous par de la soude dans l'éthanol. 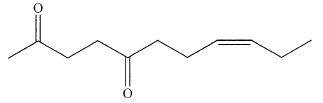 Après chauffage, on obtient un mélange de plusieurs produits dont la cis-jasmone. Proposer un mécanisme réctionnel pour la réaction. 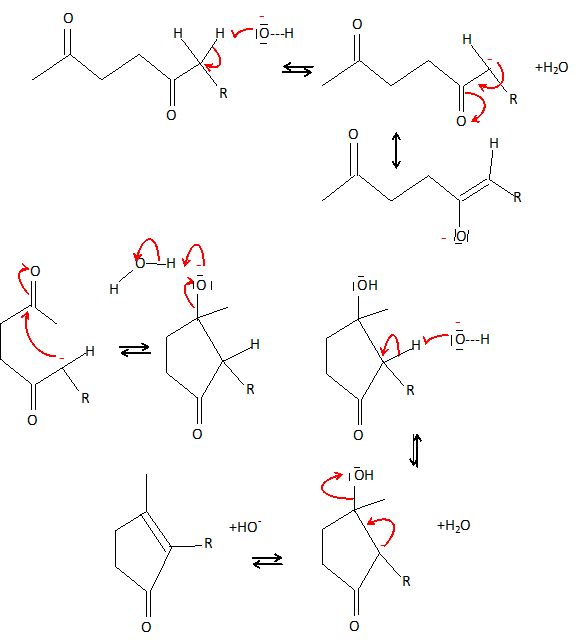
Lors d'une transformation chimique, peut-on confondre la valeur du taux d'avancement final et la valeur du rendement ? Justifier. Le taux d'avancement final fait référence à la quantité de matière du produit synthétisé. Le rendement tient compte de la quantité de matière de produit obtenu après les différentes étapes d'extraction et purification, au cours desquelles une partie du produit est perdu. On ne peut donc pas confondre ces deux valeurs. Lors d'une attaque d'un nucléophile N sur un aldehyde, indiquer quel type de réaction se produit. Adddition nucléophile sur le carbone du groupe carbonyle. Pour une réaction sous contrôle frontalier, indiquer l'interaction prépondérante entre les orbitales frontières de N et A qu'il faut étudier pour interpréter la réaction. Plus haute orbitale moléculaire occupée de N et plus basse orbitale moléculaire vacante de A. Le recouvrement entre les orbitales frontières est plus grand si N attaque sur l'atome de carbone. 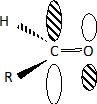 Proposer une méthode de purification des cristaux obtenus. Recristallisation. Indiquer la transformation à réaliser pour transformer le groupe -COOEt de T en groupe -COOH, on obtient alors U. Indiquer la difficulté rencontrée pour réaliser cette transformation. Saponification ( hydrolyse basique) à chaud du groupe ester, puis acidification du milieu. La lactone ( ester cyclique) ne doit pas subir d'hydrolyse. U est chauffé en milieu acide pour donner la coumarine. Indiquer de quel type de réaction il s'agit. 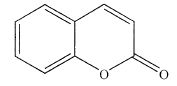 Réaction de décarboxylation. Comment se distinguent les spectres de résonance magnétiques du 1H de la coumarine et de T. 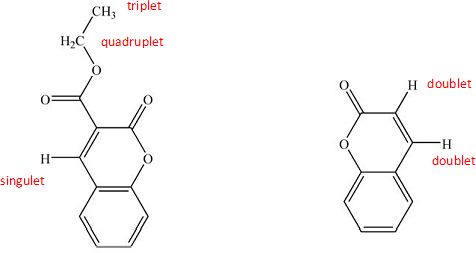 Les signaux des protons aromatiques sont identiques dans la coumarine et T. |
||||||||||||||||||
|
|