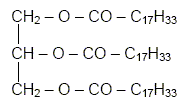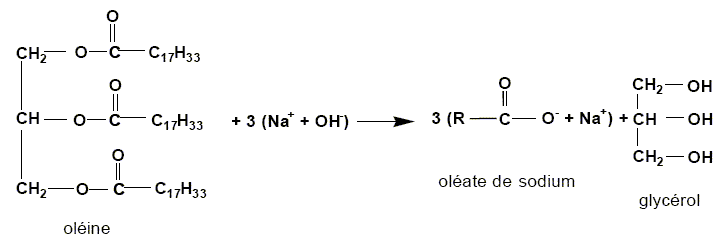.
|
|
Dans
un sauna traditionnel, il est nécessaire, lors du préchauffage,
d'amenerla température du local de q1
= 20°C à q2
= 80°C. la capacité thermique totale C du sauna et de ses accessoires
est estimée à 100 kJ K-1.
Calculer
la quantité de chaleur qu'il faut fournir pour réchauffer le local.
Q = C(q2-q1) =100(80-20)
=100*60 = 6,0 103
kJ.
A partir
de la puissance du poêle ( 4500 W ), calculer la durée minimale du
préchauffage du sauna.
Durée (s) =
Energie (J) / puissance (W)
Durée = 6,0 106 / 4500 =1333 s ~22 minutes.
Compte tenu du préchauffage, la durée de fonctionnement du sauna
traditionnel pour une première séance est de 45 min ( 25 min de
préchauffage + 20 min de séance ). Le prix du kWh est de 0,11 €.
Calculer
le coût de fonctionnement d'une première séance.
45 min = 0,75 h ; énergie consommé (kWh) = puissance ( kW) fois durée
(h) =4,5*0,75 =3,375 kWh.
Coût : 3,375 *0,11 = 0,37 €.
Pour un sauna infrarouge, le coût est évalué à 0,14 €.
Le temps de préchauffage est réduit ( 5 à 10 min ) et la
puissance est égale à 2580 W.
Expliquer
l'écart de coût de fonctionnement entre le sauna infrarouge et le sauna
traditionnel.
Durée de fonctionnement 20 +10 = 30 min = 0,5 h ; énergie
consommée : 2,58*0,5 ~1,3 kWh.
Coût : 0,11 *1,3 = 0,14 €.
Dans le sauna infrarouge, la chaleur est transmise au corps par
rayonnement grâce aux tubes infrarouges situés à l'intérieur de la
cabine.
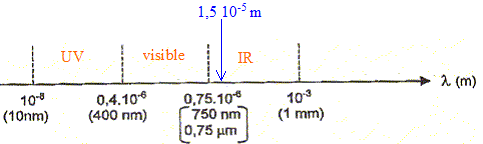
Placer
sur un axe gradué en longueur d'onde, les limites du domaine visible.
Positionner les domaines des UV et des IR.
|
Le
rayonnement infrarouge est divisé en trois domaines : les IR A ou
infrarouges courts ( l
< 1,5 µm ), les IR B ou infrarouge moyen ( 1,5 µm < l < 3 µm )
et les IR C ou infrarouge long ( l > 3µm ).
Comparer,
en justifiant, l'énergie des rayonnements IR A et IR C.
Energie = h c / l ; l'énergie est
d'autant plus faible que la longueur d'onde est plus grande.
Les IR C ayant de plus grandes longueurs d'onde que les IR A, les IR C
sont les moins énergétiques.
Quel
type d'IR, le constructeur a t-il choisi ? Justifier.
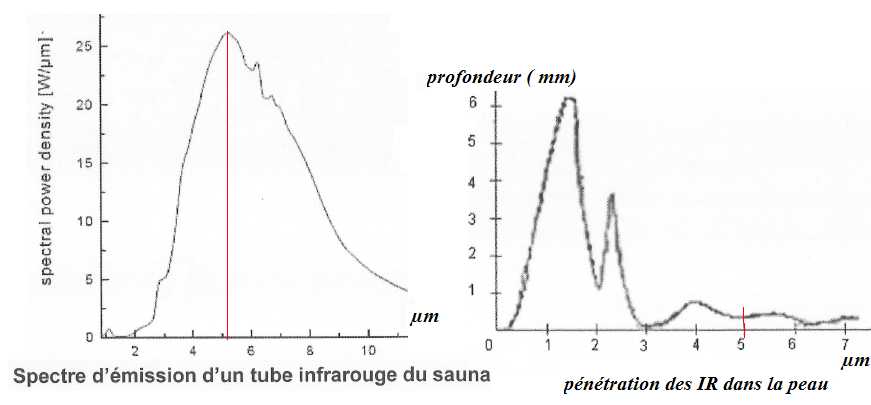
Les IR C, les moins énergétiques, pénètrent très peu dans la peau
L'huile
d'olive est constituée en grande partie d'oléine, un triester du
propan-1, 2,3-triol ( glycérol) et de l'acide oléïque de formule
semi-développée :
CH3 – (CH2)7
– CH = CH – (CH2)7 – COOH
que l'on pourra noté R-COOH.
Donner
la formule semi développée du glycérol.
HOCH2--CHOH--CH2OH.
L'acide oléïque est l'isomère Z.
Représenter
les formules semi-développées de l'acide oléïque et de son isomère E.
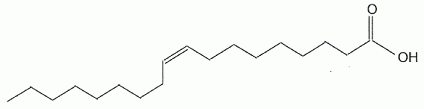
Le nom de l'acide oléïque est l'acide (Z)-octadéc-9-èneoïque. L'acide
oléïque présente une stéréoisomérie.
L'acide (E)-octadéc-9-èneoïque,
dont la formule topologique est donnée ci-dessous.
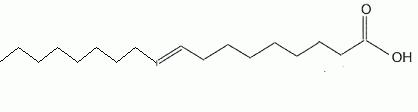
Donner
la formule semi-développée de l'oléine.
L’oléine ou trioléate de glycéryle est, un triglycéride de formule
:
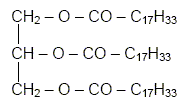
Ecrire
l'équation de la réaction de saponification de l'oléine par la soude.
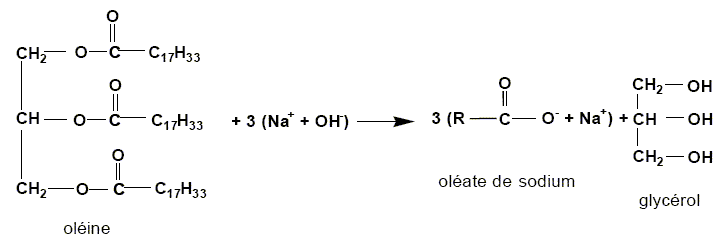
L'indice de saponification Is d'un corps gras
est la masse ( en mg ) de soude nécessaire à la saponification de m = 1
g de corps gras.
Calculer
Is pour
l'oléine. M(soude) = 40 g/mol ; M(oléine) = 884 g/mol.
Quantité de matière d'oléine n = m / M(oléine) = 1/884 =1,1312 10-3
mol.
n(soude) = 3 n = 3*1,1312 10-3 =3,3937 10-3
mol
m(soude) =n(soude) M(soude) =3,3937 10-3 *40
=0,1357 g ~136
mg.
On
souhaite déterminer expérimentalement l'indice de saponification de
l'oléine. Pour cela, on introduit dans un ballon une masse m d'oléine,
de l'éthanol, un excès de soude en quantité connue et quelques grains
de pierre ponce. On fixe un réfrigérant à reflux sur le ballon et on
chaufe le tout pendant 45 min. Après refroidissement, la soude en excès
est dosée par une solution d'acide chlorhydrique en présence d'un
indicateur coloré approprié.
Quel
est le rôle du réfrigérant à reflux ?
Les vapeurs qui se dégagent du ballon se condensent dans le réfrigérant
à eau et retombent dans le milieu réactionnel.
Quel
est le rôle de l'éthanol ?
C'est le solvant dans lequel l'oléine est soluble, alors qu'elle est
insoluble dans l'eau.
Ecrire
l'équation de la réaction entre la soude et l'acide chlorhydrique.
H3O+aq + HO-aq
= 2H2O(l).
Donner
l'allure générale de la courbe pH=f(Vacide ajouté). Placer le point
équivalent et donner la valeur du pH correspondant. Indiquer
le critère de choix de l'indicateur coloré.
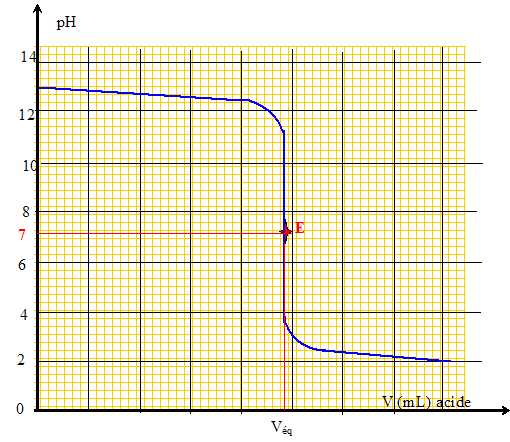
Le pH du point équivalent doit appartenir à la zone de virage de
l'indicateur coloré .
|
Parmi
les composés présents dans l'huile de laurier, on trouve l'euénol, le
linalol et le géraniol.
Recopier
la formule du géraniol et indiquer, en les nommant, les différents
groupements fonctionnels de la molécule.
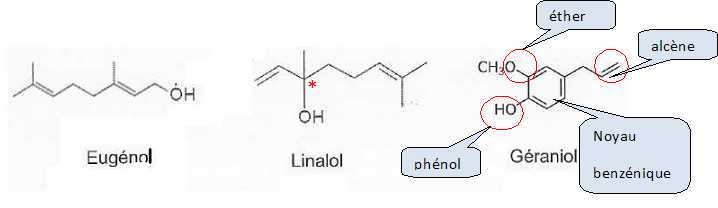
L'eugénol
et le linalol sont des isomères.
Justifier
cette affirmation et préciser le type d'isomérie.
Ils ont la même formule brute, mais des formules semi-développées
différentes.
L'une des liaisons doubles carbone - carbone occupe une position
différente dans la chaine carbonée : isomérie de chaine.
Le linalol possède une fonction alcool tertiaire, l'eugénol une
fonction alcool primaire : isomérie de fonction.
Le linalol possède un atome de carbone asymétrique.
Le
repérer et justifier san caractère asymétrique.
Un carbone
asymétrique est un atome de carbone tétragonal lié à 4 atomes ou
groupes d'atomes différents.
|