|
La décarbonatation d'une eau : BTS métiers de l'eau 2011. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||
| .
. |
||||||
|
||||||
|
le TAC détermine la teneur en carbonate et bicarbonate d'une eau. Il correspond au volume d'acide ( en mL), de concentration 0,02 mol/L en ion H3O+aq, nécessaire pour doser 100 mL d'eau en présence de vert de bromocrésol. Il s'exprime en degré français °F. On considère une eau de pH=8,3. Tracer le diagramme de prédominance des espèces et montrer qu'à ce pH son alcalinité est due principalement aux ions hydrogénocarbonate. 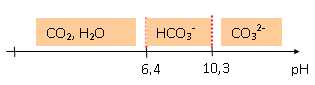 A pH=8,3, l'ion bicarbonate HCO3- aq est majoritaire. On dose une prise d'essai de 50 mL d'eau par une solution d'acide chlorhydrique de concentration C = 0,020 mol/L, en présence de vert de bromocrésol. Le volume versé à l'équivalence est VE = 17,5 mL. Ecrire l'équation bilan de la réaction de dosage. HCO3- aq + H3O+aq ---> CO2 aq +2 H2O. (2) Calculer la constante d'équilibre et montrer que la réaction est totale. K = [CO2 aq]/ ([H3O+aq][HCO3- aq]) = 1/ Ka1 =106,4. K est très grande, la réaction (2) est donc totale. Déterminer le TAC de cette eau. Pour une prise d'essai de 100 mL, le volume d'acide chlorhydrique à 0,020 mol/L versé à l'équivalence est 2*17,5 = 35 mL. TAC = 35 °F.
La décarbonatation catalytique à la soude. On réalise la précipitation du carbonate de calcium par la soude selon la réaction : Ca2+aq +2HCO3- aq +HO-aq ---> CaCO3(s) +H2O(l) + HCO3- aq. (3). Le carbonate de calcium précipite à la surface des grains de sable aditionnés de chaux, ce qui permet d'obtenir un effet catalytique et ainsi de former des billes de calcaire de l'ordre du millimètre qui sont ensuite évacuées. On considère une eau assimilable à une solution de bicarbonate de calcium dont on veut diminuer le TAC de 35°F à 20°F, c'est à dire faire passer la concentration [HCO3- aq] de 7,0 10-3 mol/L à 4,0 10-3 mol/L. On fera l'hypothèse que la concentration en ion carbonate dissous est négligeable devant celle en ions hydrogénocarbonate. Déterminer pour 1,0 L de solution : la quantité de matière d'ions hydrogénocarbonate que l'on doit précipiter. 7,0 10-3 -4,0 10-3 = 3,0 10-3 mol/L. la masse m1 de précipité de carbonate de calcium obtenu. D'après (3), n(CaCO3(s)) = ½n(HCO3- aq) ==1,5 10-3 mol/L M(CaCO3(s)) = 40 +12+3*16 = 100 g/mol. m1 =M(CaCO3(s)) n(CaCO3(s)) =100*1,5 10-3 = 0,15 g. Ce traitement est réalisé dans un réacteur qui traite sans interuption 250 m3 d'eau par heure. Vérifier que la masse de calcaire obenu après une journée de traitement est m2 = 900 kg. 250 m3 h-1 = 250*103*24 L J-1 ; m2 = 0,15 *250*103*24 =9,0 105 g =900 kg. En fin de traitement la concentration en ion calcium est 5,0 10-4 mol/L. Déterminer, à l'aide du produit de solubilité du carbonate de calcium, la concentration résiduelle en ion carbonate après traitement. La comparer à la valeur finale en ion hydrogénocarbonate et justifier l'hypothèse. Ks (CaCO3) = 5,0 10-9. Ks = [Ca2+][CO32-] ; [CO32-] =Ks / [Ca2+] = 5,0 10-9 / 5,0 10-4 = 1,0 10-5 mol/L. Cette valeur est 40 fois inférieure à 4,0 10-3 mol/L, concentration finale des ions hydrogénocarbonate. L'hypothèse " la concentration en ion carbonate dissous est négligeable devant celle en ions hydrogénocarbonate" est vérifiée.
|
||||||
|
|