|
|
Le Mediator est constitué d’un mélange racémique de benfluorex A.
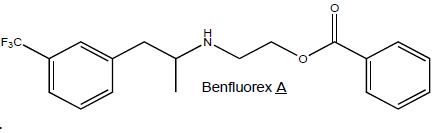
Préciser ce qu’est un mélange racémique.
Mélange en proportions égales des énantiomères lévogyre et dextrogyre d'une
molécule chirale.
Représenter
les différents stéréoisomères du benfluorex A. Préciser la (ou les)
relation(s) de stéréoisomérie entre les différents stéréoisomères en
expliquant la réponse.
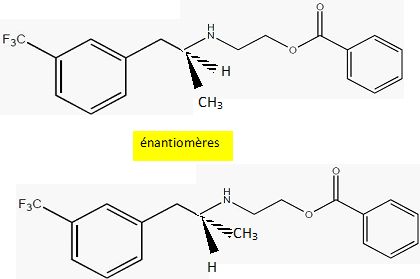
La molécule possède un seul carbone asymétrique : il existe donc deux énantiomères.
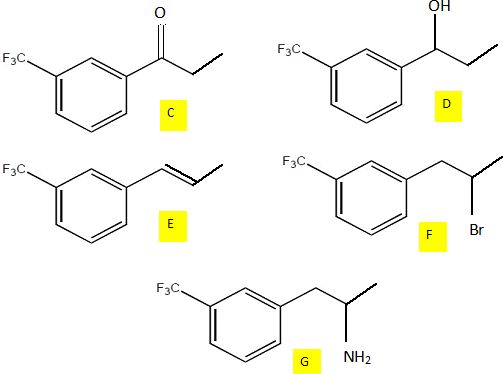
Première partie d’une voie de synthèse.
Le trifluorométhylbenzène B est traité par le chlorure de propanoyle en
présence de trichlorure d’aluminium anhydre pour obtenir un produit C.
C est dissous dans l’éthanol puis soumis à l’action du
tétrahydruroborate de sodium. Après hydrolyse, on obtient un produit D
qui présente en spectroscopie infrarouge les caractéristiques suivantes
:
Principales caractéristiques du spectre IR
|
Liaison assoxiée
|
large bande de forte intensité vers 3300 cm-1
|
liaison OH d'un alcool associée par liaison hydrogène
|
| série de bande fine et d'intensité moyenne à 3030, 3063 et 3086 cm-1 |
liaison C-H aromatique
|
| deux bandes fines et intenses à 1451 et 1493 cm-1 |
liaisons C=C aromatiques
|
| bande fine et intense à 1078 cm-1 |
liaison C-OH alcool tertiaire
|
Le chauffage de D en présence d’acide phosphorique concentré (H3PO4) conduit à un produit E de formule brute C10H9F3
et qui présente la particularité de décolorer l’eau de dibrome. E, mis
en solution dans l’hexane, est traité par du bromure d’hydrogène
gazeux, sous rayonnement UV. On obtient alors un produit F qui, traité
par un grand excès d’ammoniac, conduit à l’amine primaire G.
Représenter les composés C, D, E et F.
B---C : acylation Friedel et Crafts ; C--> D : réduction du carbonyle en alcool.
D---> E : déshydratation de l'alcool ; E--> F addition HBr sur la liaison double de la chaine latérale.
|
.
Préciser la nature du mécanisme réactionnel de la réaction conduisant à la formation de C. Détailler ce mécanisme réactionnel.
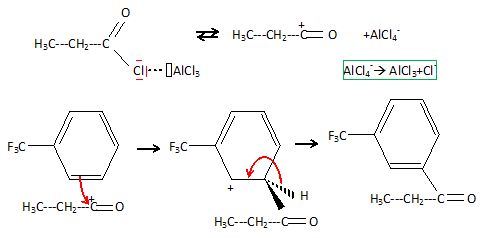
Proposer une explication quant à l’orientation de la réaction.
CF3 a un effet électronique attracteur par effet inducteur.
Il désactive toutes les positions du cycle aromatique. La position méta
est la moins désactivée.
Action du tétrahydruroborate de sodium sur C.
Donner l’équation de la réaction de la molécule C avec le tétrahydruroborate de sodium.
NaBH4 est un donneur d'hydrure.
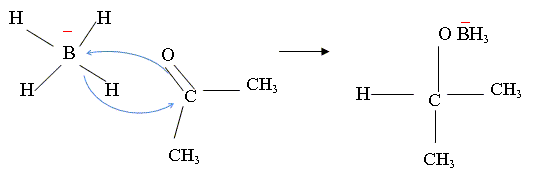
Puis (CH3)2CH
OBH3- +
(CH3)2CO =
[(CH3)2CH
O]2BH2-.
[(CH3)2CH
O]2BH2- +
(CH3)2CO =
[(CH3)2CH
O]3BH-.
[(CH3)2CH
O]3BH- +
(CH3)2CO =
[(CH3)2CH
O]4B-.
[(CH3)2CH
O]4B- +4H2O =4
(CH3)2CH OH
+B(OH)3 + HO-.
Dans notre cas 4F3C-C2H4- CO-C2H5 + NaBH4 + 4H2O= 4F3C-C2H4- CH(OH)-C2H5 +B(OH)3 + HO- + Na+.
Interpréter le spectre Infrarouge du composé D en complétant le tableau.
voir ci-dessus.
|
Formation de F.
Choisir parmi les termes suivants celui ou ceux qui décrivent le mieux la réaction de formation de F : addition / élimination / substitution / électrophile / nucléophile / radicalaire.
Addition radicalaire anti-Markovnikov ( effet Karasch ).
Expliquer les conditions expérimentales choisies pour obtenir le composé F avec la sélectivité voulue.
HBr (g) donne un radical Br. en présence d'UV.
F3C-C6H4-CH=CH-CH3 +
Br.--> F3C-C6H4-.CH- CHBr-CH3 (
formation du radical le plus stable).
F3C-C6H4-.CH- CHBr-CH3 + HBr
--> F3C-C6H4-CH2- CHBr-CH3 +
Br..
|




