L'aluminium
est connu pour ses effets néfastes à haute dose sur le système nerveux.
Les cellules du cerveau des patients atteints d''Alzheimer contiennent
de 10 à 30 ois plus d'aluminium que la normale. L'institut de la
veille sanitaire a réalisé en 2003 une étude poussée qui montre le
manque de données sufisantes pour confirmer ou infirmer les
conséquences de l'aluminium sur la santé. Les études ont portées sur la
qualité des eaux utilisées pour la boisson, mais pas sur les effets des
emballages en aluminium. D'après plusieurs articles de Wikipédia..
|
|
Les
normes actuelles tolèrent une concentration maximale de 7,4 µmol/L pour
l'eau potable. Le but de cet exercice est d'exploiter une analyse par
spectrophotométrie afin de s'assurer qu'un échantillon d'eau vérifie ce
critère.
Préparation de la solution S0.
On
prépare 1,00 L d'une solution mère de concentration 8,15 mmol/L en
élément aluminium à partir de chlorure d'aluminium hexahydraté AlCl3, 6H2O solide ( il libère des ion aluminium Al3+
lors de sa dissolution en solution aqueuse ). On prélève un volume qui
sera dilué 100 fois afin d'obtenir 100,0 mL d'une solution qui sera
appelé par la suite S0.
Retrouver
qu'il faut peser 1,97 g de chlorure d'aluminium hexahydraté de mase
molaire M = 241,5 g/mol pour préparer un litre de solution de
concentration 8,15 mmol/L en élément aluminium.
Quantité de matière de chlorure d'aluminium hexahydraté = quantité de matière d'ion aluminum = 8,15 10-3 mol.
mase (g) = quantité de matière (mol) * masse molaire (g/mol) = 8,15 10-3 *241,5 =1,97 g.
Quel est le volume de solution mère à prélever pour préparer S0 ?
Facteur de dilution : F =100.
Volume de la fiole jaugée : 100 mL ; volume de la pipette jaugée contenant la solution mère :
100 / F = 100 / 100 = 1,00 mL.
Préparation de la gamme étalon.
On
fait réagir les ions aluminium III contenus dans une solution incolore,
avec un colorant appelé aluminon présent en lare excès. Une nouvelle
espèce chimique colorée est ainsi obtenue par une transformation
chimique supposée totale.
Sept solutions sont préparées de la
façon suivante : il faut placer dans une fiole jaugée de 50,0 mL, 5 mL
d'une solution d'aluminon, 20 mL d'une solution tampon permettant de
maintenir le pH à 4,8, un certain volume de solution S0
précisé dans le tableau suivant et compléter jusqu'au trait de jauge
avec de l'eau distillée. Après homogénéisation et un temps d'attente de
15 minutes, les échantillons sont analysés par spectrophotométrie.
| solution | volume de S0( mL) | C=[Al3+] mmol /L | absorbance A | A / C (L mmol-1) | | S1 | 0 | 0 | 0 | xxxxxxxxxxxxxxxxxxx | | S2 | 1,0 | 0,16 10-2 | 0,012 | 7,5 | | S3 | 3,0 | 0,48 10-2 | 0,037 | 7,7 | | S4 | 6,0 | 1,0 10-2 | 0,072 | 7,2 | | S5 | 12,0 | 2,0 10-2 | 0,15 | 7,5 | | S6 | 15,0 | 2,4 10-2 | 0,19 | 7,9 | | S7 | 20,0 | 3,3 10-2 | 0,25 | 7,6 | | Valeur moyenne de A/C | 7,6 |
|
.
Donner un critère qui permet de choisir la longueur d'onde du spectrophotomètre.
On choisit la longueur d'onde pour laquelle la solution colorée étudiée présente un maximum d'absorption.
L'absorbance est par la suite mesurée à 525 nm.
Quelle est la verrerie , parmi la liste suivante, qui permet de prélever un volume de 5 mL, sans recherche de précision.
Becher de 100 mL, éprouvette graduée de 10 mL, pipette jaugée de 5 mL, pipette raduée de 10 mL.
Quel est le rôle de la solution S1 ?
"Faire
le blanc", mesurer l'absorbance d'une solution ne contenant pas
l'espèce colorée, correspondant à une absorbance de référence nulle.
Calculer la concentration molaire en élément aluminium de la solutin S4.
8,15 10-2 * 6,0 / 50,0 = 9,78 10-3 ~1,0 10-2 mmol/L.
Dosage de la teneur en aluminium de l'échantillon.
Tracer le graphe représentant l'absorbance A en fonction de la concentration molaire C en élément aluminium. Quelle est la relation entre A et C ?
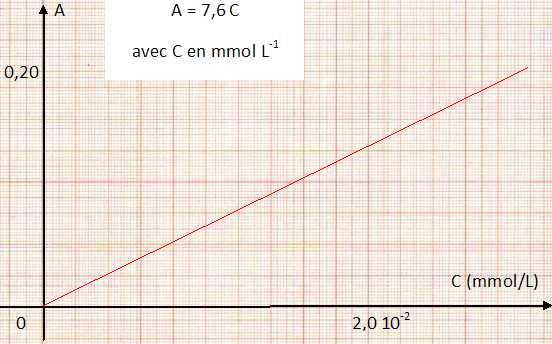
L'absorbance d'un échantillon d'eau donne une valeur de 0,12.
En déduire la
concentration molaire en aluminium pour cette eau. Cette eau
respecte-t-elle le critère de potabilité pour l'élément aluminium ?
C = A/7,6 = 0,12 / 7,6 =1,6 10-2 mmol/L = 16 µmol/L.
"Les
normes actuelles tolèrent une concentration maximale de 7,4 µmol/L pour
l'eau potable" : l'eu analysée ne respecte pas le critère de potabilité pour l'élément aluminium
Est-il
possible d'analyser, avec cette technique, des échantillons d'eau atant
une cncentratio molaire en élément aluminium environ 10 fois supérieur
à celle de lasolution S7 ? Que faut-il faire ?
Non,
pour des solutions trop concentrées, l'absorbance n'est pas
proportionnelle à a concentration : il faut diluer environ 20 fois de
telles solutions.
|
|
|
