.
|
|
Le
soja est un des aliments de base de l'alimentation japonaise. En
Occident, on peut le trouver sous forme de lait de soja. Ce dernier
peut remplacer le lait de vache dans certains régimes alimentaires. On
effectue une étude comparative de la composition de ces deux laits.
Le
lait de vache contient un glucide appelé lactose. Certaines personnes
présentant une intolérance au lactose dont les symptômes sont les
crampes d'estomac et des diarrhées.
le lactose présent dans le lait
de vache présente un test positif avec la 2,4-DNPH ainsi qu'avec
la liqueur de Fehling utilisée à chaud.
Qu'à -t-on observé lors du test positif avec la liqueur de fehling ?
On observe la formation d'un précipité rouge brique d'oxyde de cuivre (I).
Nommer le groupe caractéristique présent dans la molécule de lactose.
Les tests positifs précédents indiquent la présence du groupe caractéristique des aldehydes - CHO.
Le test à la 2, 4-DNPH est négatif dans le cas du lait de soja. Compte
tenu de cela, indiquer l'intérêt d'utiliser du lait de soja à la place
du lait de vache, dans le cadre de certains régimes alimentaires.
Ce test négatif indique l'absence du groupe carbonyle, donc sans doute
l'absence de lactose. Le lait de soja convient donc aux personnes
présentant une intolérance au lactose.
Le soja, tout comme la viande, est riche en fer. Celui-ci est donc
conseillé dans les régimes végétariens. On supposera que l'élément fer
présent dans le lait de soja se trouve exclusivement sous forme d'ion
fer (II) Fe2+.
On se propose de déterminer grâce à un dosage d'oxydoréduction,
la quantité d'ion fer (II) présente dans un litre de lait de soja puis
dans un litre de lait de vache. Pour cela on dose les ions fer(II) par
une solution aqueuse de permanganate de potassium ( K+ + MnO4-).
Donner la définition d'un oxydant.
Un oxydant est une espèce susceptible de gagner un ou plusieurs électrons.
L'équation de la réaction d'oxydoréduction mise en jeu au cours du dosage est :
5Fe2+ + MnO4- + 8H+ = Mn2+ + 5Fe3+ + 4H2O.
Les couples mis en jeu sont : Fe3+/ Fe2+; MnO4-/ Mn2.
L'ion permanganate joue-t-il le rôle d'oxydant ou de réducteur au cours de cette réaction ?
L'ion permanganate gagne des électrons : c'est un oxydant qui se réduit.
MnO4- + 8H+ + 5e-= Mn2+ + 4H2O.
|
.
On vous propose trois schémas de montage.
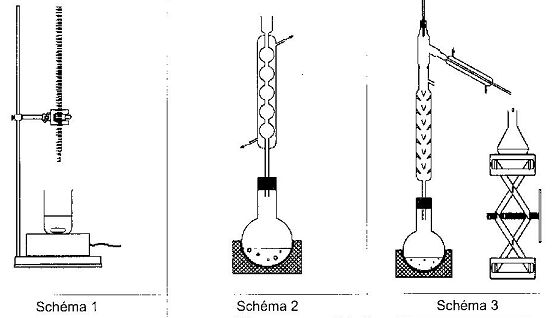
Donner le numéro de celui qui convient.
Le schéma 1 est le montage qui convient pour le dosage.
On dose un volume V1 = 50,0 mL de lait de soja par une solution de permanganate de potassium de concentration c2 =2,0 10-4 mol/L. L'équivalence est obtenue pour un volume de solution de permanganate de potassium V2E =6,0 mL. On observe alors une coloration rose persistante.
Parmi la liste suivante, nommer la verrerie nécessaire pour prélever de façon précise 50,0 mL de lait.
Verre à pied, éprouvette graduée de 50,0 mL, pipette jaugée de 50 mL.
On utilise une pipette jaugée de 50 mL pour mesurer un volume précis.
Définir l'équivalence d'un dosage.
A
l'équivalence les quantités de matière des réactifs sont en proportions
stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès,
après l'équivalence, l'autre réactif est en excès.
Montrer que la quantité de matière n2 d'ion permanganate ajouté à l'équivalence est égale à 1,2 10-6 mol.
n2 = V2E C2 =6,0 10-3 *2,0 10-4 = 1,2 10-6 mol.
Sachant qu'une mole d'ion permanganate réagit avec 5 moles d'ion fer(II), montrer que la quantité de matière n1 d'ion fer(II) présents dans l'échantillon de lait de soja est 6,0 10-6 mol.
D'après les nombres stoechiométriques de l'équation de dosage, n1 = 5 n2 = 5*1,2 10-6 = 6,0 10-6 mol.
En déduire la concentration c1 en ion fer(II) du lait de soja.
c1 = n1/V1 = 6,0 10-6 / (50,0 10-3) =1,2 10-4 mol/L.
Dans les mêmes conditions, on réalise le dosage des ions fer(II) dans
du lait de vache. La coloration rose apparaît dès l'ajout de la
première goutte de la solution de permanganate de potassium.
Que peut-on en déduire quant à la teneur en ion fer(II) de ce lait de vache ?
Ce lait de vache ne contient pratiquement pas d'ion fer(II).
|
|
|
