.
|
|
Les algues
sont employées par les hommes depuis la préhistoire. Elles sont la base
de la chaîne alimentaire en mer et sont donc l’un des fondements de la
vie. Si au siècle dernier, les algues ont surtout nourri les peuples
littoraux et servi à
fertiliser leurs sols pour les cultures, on leur découvre aujourd’hui
dans le monde entier, en plus d’une valeur gastronomique, des vertus
pour la santé. Les algues alimentaires les plus populaires nous
viennent principalement du Japon où elles font véritablement parties
des us et coutumes.
Le Wakame est une algue brune japonaise réputée pour son action
bienfaisante sur la peau, les cheveux et les ongles. Mélangée à des
huiles végétales à base d’olive, de coco ou de chanvre, cette algue
entre dans la fabrication de savons utilisés en cosmétique.
Partie A : Préparation
du savon.
Le montage expérimental utilisé lors de la première étape de la
préparation du savon est schématisé ci-dessous :
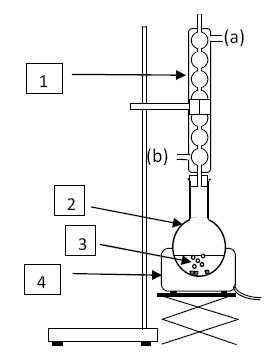
Nommer
les 3 éléments du montage expérimental notés 1, 2 et 4.
1 : réfrigérant à eau ; 2 : ballon ; 4 : chauffe-ballon.
Pourquoi
faut-il chauffer le mélange réactionnel noté 3 ?
La réaction est lente à température ambiante ; en travaillant à
température plus élevée, on accélère la réaction chimique.
Que
représentent les deux parties (a) et (b) du montage.
(b) : arrivée de l'eau ; (a) : sortie de l'eau.
Étude
de la réaction de fabrication du savon.
On prépare au laboratoire un savon à raser à partir de m=50,0 g de
stéarine, triglycéride de formule C57H110O6,
et d’un volume de 100,0 mL de potasse, aussi appelée solution
d’hydroxyde de potassium de formule (K+ + HO-),
de concentration 10,0 mol.L-1. L’équation de la
réaction s’écrit :
C57H110O6
+ 3 HO- ---> 3 CH3-(CH2)16-COO-
+ C3H8O ( molécule A )
Donner
le nom de la réaction entre la stéarine et la solution de potasse.
Saponification ou hydrolyse basique.
Donner la
formule semi-développée de la molécule A obtenue. Quel est le nom de
cette molécule ?
HOCH2-CHOH-CH2OH,
glycérol ou propan-1, 2, 3-triol.
La stéarine est un triglycéride
de formule C57H110O6.
Montrer
que la masse molaire de la stéarine vaut Ms = 890
g.mol-1.
Données : Masses molaires atomiques en g.mol-1 : M(H) = 1 ; M(C) = 12 ;
M(O) = 16.
Ms = 57*12+110+6*16 =890 g/mol.
Calculer
la quantité de matière ns de
stéarine introduite lors de la fabrication du savon.
ns = m /Ms = 50,0 / 890 =
5,618 10-2 ~5,62 10-2 mol.
En
déduire qu’il se forme n = 1,69 x 10-1 mol d’ion
carboxylate.
D'après les nombres stoechiométriques de l'équation n = 3 ns
= 3*5,618 10-2
=1,6854 10-1~0,169 mol.
|
.
Partie B : Efficacité
du savon.
Le savon préparé contient l’ion carboxylate de formule CH3-(CH2)16-COO- .
On peut représenter schématiquement l’ion carboxylate du savon par :
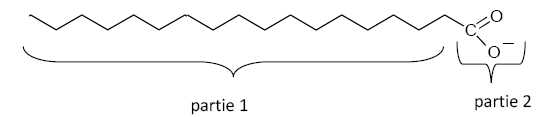
Identifier
qu’elle est la partie hydrophile et hydrophobe de l’ion carboxylate
?
Partie 1 : partie hydrophobe ; partie 2 : partie hydrophile.
L’efficacité
d’un savon est-elle augmentée dans une eau dure ?
Une
eau dure contient des ions calcium et magnésium qui piègent les ions
carboxylate sous la forme d'un précipité : le savon est moins efficace
dans une eau dure.
Algues
et acides aminés.
La Nori désigne une algue rouge comestible, très utilisée dans la
cuisine japonaise. Séchée, elle se présente sous la forme de feuilles
noires ou vertes qui entrent dans l’élaboration des fameux sushis.
Cette algue est un aliment souvent recommandé dans les régimes
végétariens car elle contient les huit acides aminés essentiels qui
représentent jusqu’à 47% de sa matière sèche.
La leucine et la valine sont deux acides aminés essentiels décrits par
les formules semi-développées ci-dessous :
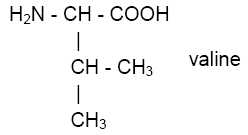 |
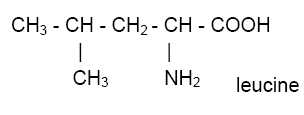 |
Après
avoir recopié la formule de la leucine, entourer et nommer les deux
groupes fonctionnels qui justifient le nom d’acide a-aminé donné
aussi à cette molécule.
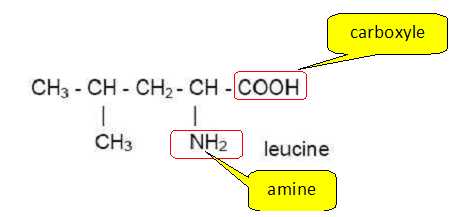
Le groupe acide carboxylique et le groupe amine sont portés par le même
atome de carbone : d'où le nom d'acide a-aminé.
Qu’appelle-t-on
atome de carbone asymétrique ?
Un atome de carbone asymétrique est un atome de carbone tétragonal
portant 4 atomes ou groupes d'atomes différents.
Repérer,
sur la formule recopiée précédemment, l’atome de carbone asymétrique à
l’aide d’un astérisque *.
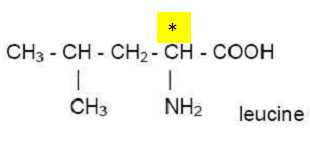
La molécule de leucine est-elle chirale ? Justifier.
La leucine possédant un atome de carbone asymétrique est chirale.
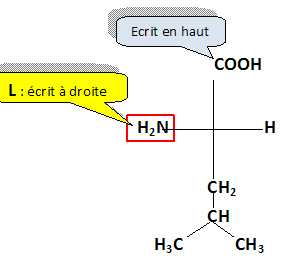
Représenter, en projection de Fischer, la configuration L de la
Leucine.
On fait réagir une mole de leucine avec une mole de valine.
Combien de dipeptides différents peut-on obtenir si on ne prend
pas de précautions particulières ?
On peut obtenir 4 dipeptides : Val-Val ; Leu-Leu ; Val-Leu ; Leu-Val.
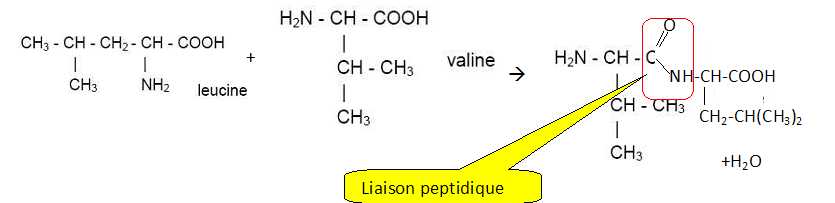
L’un des dipeptides, obtenus par condensation de la valine avec la
leucine, est noté Val-Leu.
Ecrire l’équation de la réaction de synthèse de ce
dipeptide en utilisant les formules semi-développées. Encadrer la liaison peptidique dans la formule du dipeptide obtenu.
|
|
|







