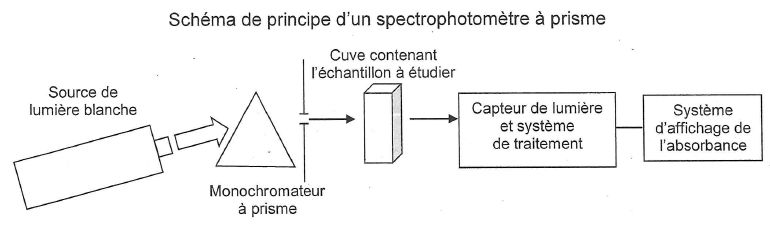
Le
principe de la spectrophotométrie repose sur la mesure de l'absorbance
A de l'espèce X en solution dans un solvant Y. cette grandeur est le
résultat de la comparaison de deux intensités lumineuses : celle d'une
radiation monochromatique ayant traversée une cuve transparente
contenant le solvant Y, et celle de la même radiation élmergent de la
même cuve contenant la solution de l'espèce X dans le solvant Y.
|
|
Lumière et
spectrophotométrie.
Donner les valeurs
limites des longueurs d'onde du spectre visible dans le vide et les
couleurs correspondantes.
400 nm : violet ; 800 nm : rouge.
Situer,
du point de vue de leur longueur d'onde, les rayonnements ultraviolets
et infrarouges par rapport au visible.
Les longueurs d'onde des UV sont inférieures à 400 nm ; celles des
infrarouges sont supérieures à 800 nm.
Le rôle du monochromateur dans un spectrophotomètre est de sélectionner
une radiation monochromatique particulière.
Donner la définition
d'une lumière monochromatique.
Une lumière monochromatique est constituée d'une onde possédant une
seule fréquence, c'est à dire une seule couleur.
Certains monochromateurs comportent un prisme en verre.
Définir
l'indice de réfraction n d'un milieu transparent.
L'indice de réfraction est le rapport de la célérité de la lumière dans
le vide à celui de la célérité de la lumière dans le milieu transparent.
De
quel paramètre caractéristique d'une radiation lumineuse dépend
l'indice n pour un milieu transparent donné ?
L'indice de réfraction dépend de la longueur d'onde de la radiation
lumineuse.
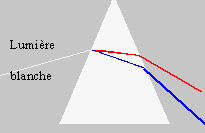
Le prisme de verre décompose la lumière blanche.
Nommer le phénomène
responsable de cette décomposition et le décrire brièvement.
Un prisme
de verre disperse ( phénomène de dispersion) la lumière blanche. A la
sortie du prisme on observe un arc en ciel, le bleu étant plus dévié
que le rouge.
Lors d'une réfraction air-verre, la déviation
d'une radiation lumineuse est d'autant plus importante que la longueur
d'onde de la radiation est faible. Sans faire de calcul
compléter la
figure en y faisant figurer le trajet d'un rayon lumineux bleu et
d'un rayon lumineux rouge à l'intérieur du prisme et après sa sortie.
|
.
Dosage colorimétrique par étalonnage.
On
se propose de déterminer la concentration en diiode dans une teinture
d'iode officinale. On dilue 200 fois la teinture d'iode trop
concentrée pour une étude spectrophotométrique directe. La
solution diluée est notée S.
Par ailleurs, on dispose d'un ensemble de solutions aqueuses de diiode notées Di de concentrations connues toutes différentes. Ces solutions ont des colorations proches de la solution S.
Masse molaire de l'iode M = 127 g/mol.
On peut trouver expérimentalement un encadrement de la concentration en
diiode de la solution S, sans utiliser de spectrophotomètre.
Expliquer brièvement la méthode.
On réalise une échelle de teintes à partir de solutions de concentrations connues de diiode. On situe la solution S
par comparaison dans cette gamme de teintes.
Pourquoi lors de la mise en oeuvre de cette méthode, faut-il que les récipients utilisés soient tous identiques ?
On
compare les teintes de solutions de concentrations connues à celle de
la solution S, dont la couleur doit être située dans la gamme.
La comparaison n'est possible et fiable que si tous les récipients sont identiques.
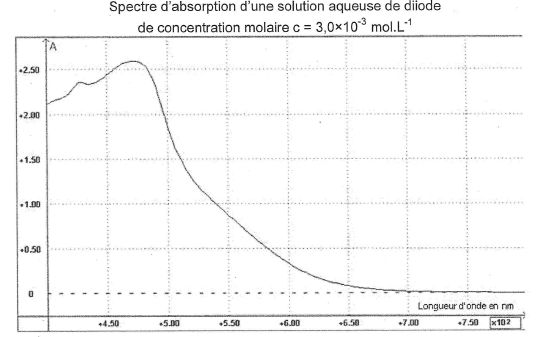
A l'aide d'un spectrophotomètre, on mesure l'absorbance Ai de chaque solution Di de diode, puis celle de la solution S.
Donner la valeur d'une longueur d'onde qui vous paraît bien appropriée et justifier.
On choisit une longueur d'onde pour laquelle la solution présente un maximum d'absorption.
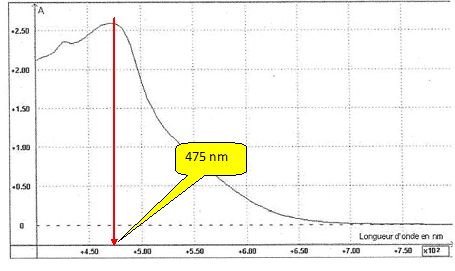
On obtient les résultats suivants :
concentration C ( µmol/L)
|
50
|
100
|
250
|
500
|
750
|
1000
|
absorbance A
|
0,041
|
0,10
|
0,22
|
0,46
|
0,70
|
0,87
|
Absorbance de la solution S : A = 0,78.
La courbe d'étalonnage de l'absorbance en fonction de la concentration
est fournie ci-dessous. La relation entre l'absorbance A et la
concentration C est appelée loi de Beer-Lambert. Elle s'écrit A = k C
avec k une constante et C la concentration molaire de l'espèce colorée
dans la solution.
La courbe d'étalonnage est-elle en accord avec cette loi ? Justifier.
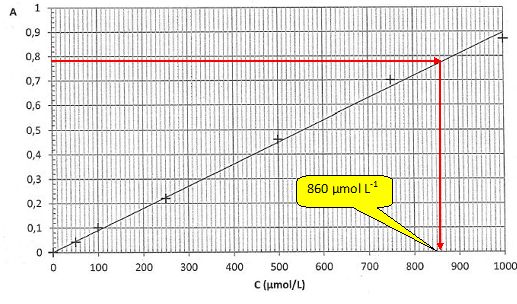
La
courbe est une droite passant par l'origine ; son équation est de la
forme A = k C, ce qui est en accord avec la loi de Beer-Lambert.
Déterminer graphiquement la concentration molaire CS exp en diiode de la solution S. En déduire la concentration molaire Cexp en diiode de la teinture d'iode officinale.
CS exp = 860 µmol /L ~8,6 102 µmol /L Cexp = 200 CS exp =200 *8,60 10-4 =0,172~0,17 mol/L.
La teinture d'iode officinale est étiquetée à 5,0 % en masse de diiode. Sa masse volumique est r = 9,0 102 g/L.
Vérifier que la concentration massique Cm en diiode attendue dans cette teinture est 45 g/L.
Masse de un litre de solution : 900 g ; masse de diiode dans un litre de solution : Cm = 900*0,05 =45 g /L.
En déduire la concentration molaire attendue Ca en diiode dans cette teinture.
Ca = Cm / M(I2) = 45/(127*2) =0,177 ~0,18 mol/L.
Calculer l'écart relatif entre la valeur expérimentale à la valeur attendue et conclure.
|Cexp-Ca| *100 / Ca= (0,177-0,172) *100 / 0,177 =2,8 %.
Cet écart est très faible, les résultats expérimentaux sont en accord avec l'indication de l'étiquette.
|
|
|




