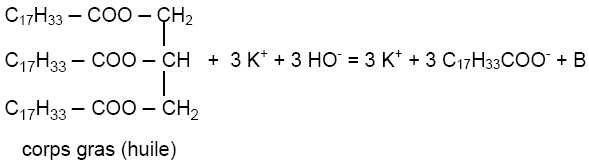La
saponification est définie comme la réaction entre un alcali (la
lessive) et un corps gras (huile ou graisse). Les composés formés sont
le savon et la glycérine.
Schéma d'un corps gras (extrait d'un document à vocation économique) :
D'après http://www.atol.be/docs/publ/fabrication_savon.pdf
L’objectif de cet exercice est d’apporter quelques précisions.
|
|
PARTIE
A : La réaction de saponification.
Donner
le nom et la formule de l'espèce chimique qu’il est possible d’utiliser
en travaux pratiques pour la préparation du savon et qui correspond à
"l'alcali" du texte.
Hydroxyde de potassium KOH ou hydroxyde de sodium NaOH.
À
quelle famille de composés chimiques, le corps gras appartient-il
?
Les triglycérides, triesters du glycérol.
Le
trioléate de glycéryle.
On
fait l'hypothèse que le corps gras précédent est du trioléate de
glycéryle et qu'il réagit avec l'hydroxyde de potassium. Dans
l'équation ci-dessous, modélisant la transformation, l’espèce appelée
glycérine dans le texte est notée "B".
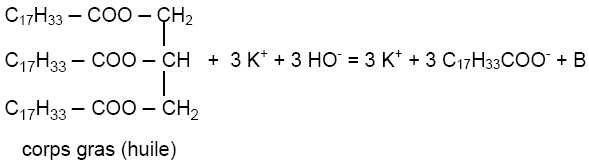
D’après
l’équation ci-dessus, écrire la formule semi-développée de B. Donner la
formule du savon ainsi préparé.
B est le glycérol ou propan-1, 2,3 triol HOCH2-CHOH-CH2OH.
Le savon est l'oléate de potassium C17H33COO-
+ K+.
Écrire
la formule de l'acide gras qui permet d’obtenir le trioléate de
glycéryle.
acide oléïque : C17H33COOH.
Le
schéma du corps gras proposé dans le texte d’introduction ci-dessus
vous paraît-il rigoureux d’un point de vue scientifique ? Justifier.
Le
schéma n'est pas rigoureux. Le corps gras est un triester du glycérol (
ou glycérine), obtenu par action d'acide gras sur le glycérol avec
élimination de trois molécules d'eau.
|
PARTIE
B : Indice de saponification de l'huile d'olive.
Données
:
- Masse molaire du trioléate de glycéryle (noté G) : 885 g.mol-1
;
- Masse molaire de l’hydroxyde de potassium : 56,1 g.mol-1
;
-
Définition de l'indice de saponification d'un corps gras : dans les
conditions de l'exercice, c’est la masse d’hydroxyde de potassium
exprimée en mg, nécessaire pour saponifier 1 g de corps gras.
- La réaction de saponification sera considérée comme totale.
Lors
d'une séance de travaux pratiques, on mélange 0,50 g d'huile d'olive,
supposée uniquement constituée de trioléate de glycéryle, avec 50,0 mL
d'une solution d'hydroxyde de potassium de concentration 0,250 mol.L-1
en solution dans l'éthanol. On chauffe à reflux pendant trente minutes,
puis on laisse refroidir le contenu du ballon, qu’on verse ensuite dans
250 mL d'une solution saturée en chlorure de sodium.
Le trioléate de glycéryle est noté G dans l'équation du tableau
d’avancement.
Détermination de
l’indice de saponification.
Faire
un schéma annoté du dispositif de chauffage à reflux.
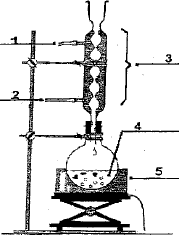
|
(1) sortie de l'eau
(2) entrée de l'eau
(3) réfrigérant
(4) ballon
(5) chauffe ballon
|
Calculer
les quantités de matière initiales n01 et n02 des
réactifs puis compléter le tableau descriptif de l'évolution de la
réaction.
n01 =0,50 / 885 = 5,6497 10-4
~5,65 10-4 mol.
n02 =0,050*0,250 =1,25 10-2
mol.
| état |
avancement(mol) |
G |
+3HO- |
---> 3C17H33COO- |
+B |
| initial |
0 |
n01 |
n02 |
0 |
0 |
| en
cours |
x |
n01-x |
n02-3x |
3x |
x |
| fin |
xf |
n01-xf |
n02-3xf |
3xf |
xf |
Déterminer
la valeur de xf.
Si G est en défaut : 5,65 10-4 - xf =
0 ; xf = 5,65 10-4
mol.
Si est en défaut : 1,25 10-2 -3xf
= 0 ; xf = 1,25 10-2
/ 3 = 4,2 10-3 mol.
On retient la plus petite valeur : xf = 5,65
10-4 mol.
Calculer
la quantité finale d’hydroxyde de potassium.
n02-3xf = 1,25
10-2 - 3*5,6497 10-4
~1,08 10-2 mol.
Indice de
saponification.
Calculer
la quantité de matière d'hydroxyde de potassium qui a réagi.
3*5,6497 10-4 =1,6919 10-3
~1,69 10-3 mol.
En
déduire la masse correspondante.
m = n M = 1,6919 10-3 *56,1 =9,49 10-2
g = 94,9 mg pour saponifier 0,5 g de corps gras.
En
utilisant la définition donnée ci-dessus, calculer l'indice de
saponification de l'huile d'olive.
94,9*2 ~190 mg pour saponifier 1,0 g de corps gras.
Détermination
expérimentale de l'indice de saponification.
L'indice
de saponification précédemment calculé est un indice théorique. Une
détermination expérimentale de cet indice est réalisée de la façon
suivante :
on effectue un titrage acido-basique de l'hydroxyde de
potassium en excès dans la réaction étudiée, par une solution d'acide
chlorhydrique (H3O+aq + Cl-aq)
de concentration CA=0,500
mol.L-1 en présence de bleu de bromothymol.
Écrire
l'équation de la réaction de titrage.
H3O+aq
+ HO-aq ---> 2H2O(l).
Le volume solution d'acide chlorhydrique
nécessaire pour obtenir l'équivalence est égal à VE1=22,0
mL.
Définir
l'équivalence.
A
l'équivalence, les quantités de matière des réactifs sont en
proportions stoéchiométriques. Avant l'équivalence, l'un des
réactifs est en excès, après l'équivalence, l'autre réactif est en
excès.
Calculer
la quantité de matière d'ions HO- titrés.
CA
VE1 =0,500
*22,0 10-3 = 0,0110 mol.
En
déduire la quantité de matière d'ions HO- ayant
réagi lors de la réaction étudiée puis l'indice de
saponification expérimental de l'huile d'olive.
1,25
10-2 -0,0110 =1,50 10-3
mol.
m = n M = 1,50 10-3 *56,1 =8,415 10-2 g = 84,2 mg pour saponifier
0,5 g de corps gras.
84,15*2 ~168 mg pour saponifier 1,0 g de corps gras.
Comparer
cet indice expérimental avec l'indice théorique. Proposer une
explication.
Ecart relatif : (190-168) / 190 ~0,12 ( 12 %).
Dans le corps
gras, une petite partie du triester est hydrolysé et il existe un peu
d'acide gras libre qui va réagir avec l'hydroxyde de potassium.
La concentration de la solution d'hydroxyde de potassium n'est pas
connue avec une grande précision, si celle-ci n'est pas fraichement
préparée.
On aurait pu ajouter le titrage
suivant :
Prise témoin : on opère de façon identique à la prise d'essai mais sans
ajouter de triglycéride. La décoloration est obtenue pour un volume VE2 mL d'acide versé.
Quantité de
matière d'hydroxyde de potassium utile à la saponification : n=
(VE2 -VE1 ) CA.
|
|
|