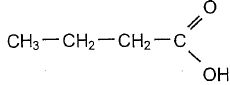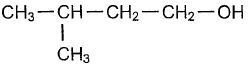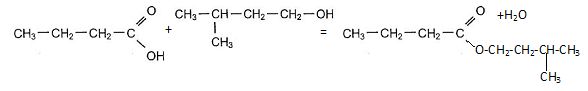Les
parfums naturels, très chers car difficile à extraire et à purifier,
sont souvent remplacés par des produits chimiques synthétiques moins
couteux. Dans cet exercice, nous reproduirons l'odeur fruitée de la
pomme par une réaction conduisant à la molécule de butanoate
d'isoamyle. On peut préparer le butanoate d'isoamyle,( composé E
) par action de l'acide butyrique [A) sur l'alcool amylique (B).
|
|
Nom usuel
|
Formule
|
M(g/mol)
|
r(g/mL)
|
Température d'ébullition (°C)
|
acide butyrique A
|
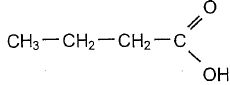
|
88,0
|
0,963
|
162
|
alcool isoamylique B
|
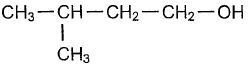
|
88,0
|
0,813
|
132
|
butanoate d'isoamyle E
|
C9H18O2
|
158
|
0,866
|
178
|
Etude de la transformation chimique.
Donner le nom de l'acide A dans la nomenclature officielle.
Acide butanoïque.
A quelle famille de composés chimiques le butanoate d'isoamyle E appartient-il ?
E est un ester.
Ecrire l'équation de la réaction de synthèse de E en utilisant les formules semi-développées.
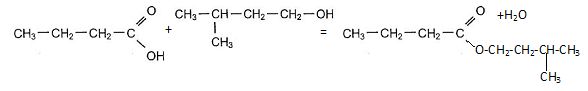
Quelles sont les caractéristiques de cette transformation chimique ?
L'estérification est lente, athermique, limitée par l'hydrolyse de l'ester.
Etude du protocole opératoire.
On introduit dans un ballon un volume VA = 11 mL d'acide butyrique A et un volume VB = 13 mL d'alcool B. On ajoute quelques gouttes d'acide sulfurique et quelques grains de pierre ponce.
Le montage utilisé est représenté ci-dessous :
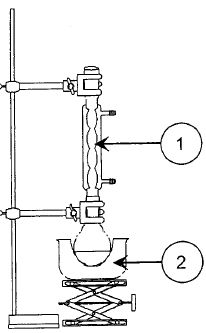
Comment nomme t-on ce type de montage ? Nommer les éléments 1 et 2. Quels sont les deux intérêt d'un tel dispositif ?
Le dispositif de chauffage à reflux accélére la réaction en travaillant à température modérée ( la
température est un facteur cinétique ), tout en évitant les pertes de
matière : les vapeurs se condensent dans le réfrigérant et retombent
dans le milieu réactionnel.
1 : réfrigérant à eau ; 2 : chauffe ballon.
|
Quel est le rôle de l'acide sulfurique ?
Un catalyseur accélère la réaction d'estérification ainsi que la
réaction inverse d'hydrolyse sans modifier la composition du mélange à
l'équilibre.
Etude du rendement.
La constante d'équilibre K associée à cette réaction a pour valeur 4,0.
Etat initial :
Ecrire l'expression du quotient de réaction Qri dans l'état initial de la transformation.
Qri = [eau]i[E]i / ([A]i[B]i.
Justifier le sens d'évolution spontanée du système.
Qri < K, donc évolution spontanée dans le sens direct.
Calculer les quantités de matière initiales des réactifs. Le mélange initial est-il stoechiométrique ?
n(A) = VA rA / M(A) = 11 *0,963 / 88,0 =0,12 mol.
n(B) = VB rB / M(B) = 13 *0,813 / 88,0 =0,12 mol.
Le mélange initial est stoechiométrique.
Compléter numériquement le tableau d'évolution.
|
avancement (mol)
|
A
|
+B
|
=E
|
+H2O
|
initial
|
0
|
0,12
|
0,12
|
0
|
0
|
en cours
|
x
|
0,12-x
|
0,12-x
|
x
|
x
|
fin
|
xéq
|
0,12 -xéq |
0,12 -xéq |
xéq |
xéq |
Etat final.
Montrer que la valeur xéq = 0,080 mol.
4 = [eau]éq[E]éq / ([A]éq[B]éq = xéq2 / (0,12 -xéq)2 ;
xéq / (0,12 -xéq) = 2 ; xéq = 2 (0,12 -xéq) ; 0,24 =3xéq ; xéq= 0,080 mol.
Exprimer puis calculer le taux d'avancement final t de cette réaction.
t = xéq / xmax = 0,08 / 0,12 = 0,67.
Quelle masse d'ester peut-on espérer obtenir ?
0,080 M(E) = 0,080 *158 = 12,64 ~13 g.
Suivi cinétique.
Il est possible de suivre l'évolution de l'avancement au cours du temps pour le mélange réactionnel de volume V = VA + VB.
Donner la définition de la vitesse volumique de la réaction.
v = 1 / V dx/dt avec x, l'avancement en mol.
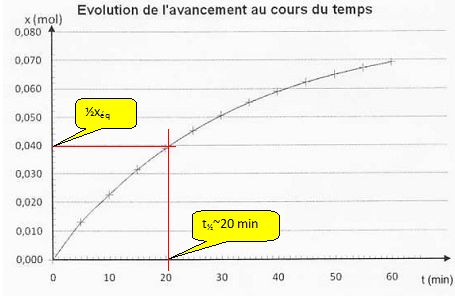
Comment cette vitesse évolue-t-elle au cours du temps ? Justifier graphiquement.
dx/dt
est égal au coefficient directeur de la tangente à la courbe à une date
donnée. Or les tangentes sont de moins en moins inclinées sur
l'horizontale. Leur coefficient directeur, donc la vitesse de la
réaction, diminue au cours du temps.
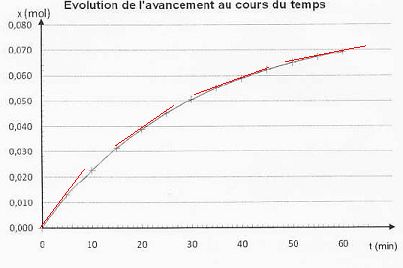
Peut-on considérer que la réaction est terminée au bout d'une heure ? Justifier.
Au bout d'une heure, l'avancement est voisin de 0,070 mol, inférieur à xéq. La réaction n'est pas terminée.
Définir puis déterminer graphiquement le temps de demi-réaction.
Le temps de demi-réaction, noté t½, est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
|
Amélioration du rendement.
Pour améliorer le rendement de cette synthèse, deux propositions sont formulées :
a) augmenter la température ;
b) éliminer du mélange l'espèce chimique dont la température d'ébullition est la plus basse.
Pour chaque proposition, indiquer en justifiant si elle permet d'augmenter le rendement.
a) La
température est un facteur cinétique : en l'augmentant on fait croître
la vitesse des réactions d'estérification et d'hydrolyse. L'équilibre
est plus rapidement atteint mais sa composition reste inchangé.
b) En éliminant l'un des produits au fur et à mesure qu'il se forme, on
déplace l'équilibre dans le sens direct. Il se forme d'avantage d'ester
et le rendement croît.
Le rendement peut être nettement amélioré en remplaçant l'acide A par l'anhydride butanoïque.
Donner la formule semi-développée de cet anhydride.
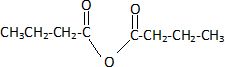
Nommer le produit qui se forme en plus de E lors de cette nouvelle synthèse.
L'acide butanoïque.
Donner les caractéristiques de cette réaction.
Rapide, totale, exothermique.
|