.
|
|
Certains
gaz de l'atmosphèe sont capable de se dissoudre dans le gouttes
d'eau des nuages ou des brouillards. Il en résulte que certaines pluies
sont acides, dégradant végétaux et constructions. On donne la
composition d'un air sec non pollué :| Gaz | diazote | dioxygène | argon | dioxyde de carbone | néon | hélium | méthane | krypton | | Formule | N2 | O2 | Ar | CO2 | Ne | He | CH4 | Kr | | Volume en % ou ppm | 78,09 % | 20,5 % | 0,93 | 0,03 % | 18 ppm | 5,2 ppm | 1,1 ppm | 1,1 ppm |
Analyse des gaz d'échappement d'une voiture.
| Gaz | Composé organique
volatil | CO | CO2 | NOx | SO2 | | Moteur essence | 500 à 2000 ppm | 0,1 à 6 % | 10 à 14 % | 400 à 3000 ppm | 10 à 60 ppm | | Moteur Diesel | ~1500 ppm | 2 à 18 % | 2 à 14 % | 0 à 500 ppm | 5 à 60 ppm |
On donne la teneur en soufre de quelques combustibles :| Charbon | pétrole brut | fuel lourd | essence et diesel | fuel domestique | propane | | 1 à 5 % | 0,5 à 3 % | 3 % | < 10 ppm | <0,1 % | <0,005 % |
M(O2) = 32 g/mol ; M(S) = 32,1 g/mol ; Vm= 24 L/mol à 20°C sous 1 bar.
pKa1(CO2, H2O / HCO3-) = 6,35 ; pKa2( HCO3- / CO32-) = 10,32.
A 20 °C sous 1 bar, 1 L d'eau peutdissoudre 40 L de dioxyde de soufre.
SO2(g) + 3H2O(l) ---> 2H3O+aq + SO32-aq.
Le pH d'une eau de pluie non polluée est proche de 5,5. Proposer une explication.
Le dioxyde de carbone atmosphérique est un peu soluble dans l'eau. Or CO2 aq est un acide faible.
CO2 aq+ H2O(l) = HCO3-aq + H3O+aq.
Expliquer la présence du dioxyde de soufre dans les gaz d'échappement d'une voiture.
L'essence
ou le diesel contiennent jusqu'à 10 ppm de soufre. La combustion de ce
dernier dans le moteur conduit au dioxyde de soufre.
S(s) + O2(g) = SO2(g).
Expliquer pourquoi le dioxyde de soufre est à l'origine des pluies acides ?
La
combustion du charbon, du fuel lourd et des combustibles des voitures
dégage du dioxyde de soufre dans l'atmosphère ; or ce dernier est très
soluble dans l'eau ; de plus le dioxyde de soufre est acide.
SO2(g) + 3H2O(l) ---> 2H3O+aq + SO32-aq.
|
.
Dosage du dioxyde de soufre dans une eau polluée.
On
réalise la combustion du soufre ( m = 1 g) dans un creuset placé dans
un flacon bouché de 1 L contenant du dioxygène. On y ajoute 200 mL d'eau
distillée après combustion complète, on agite le flacon, le dioxyde de
soufre se dissout et la solution obtenue est acide ; de plus la
solution décolore quelques gouttes de permanganate de potassium :
2 MnO4-aq + 5 SO2 aq + 2H2O(l) ---> 5 SO42-aq + 2Mn2+aq + 4H+aq.
Volume de la prise V = 10 mL ; concentration de la solution de permanganate de potassium ; C = 0,03 mol/L.
Faire un schéma annoté du dispositif expérimental.
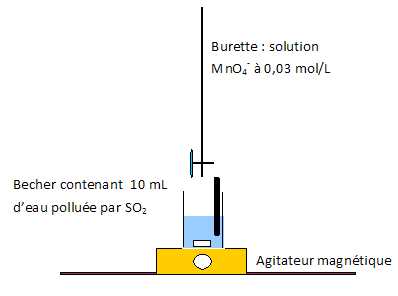
Calculer le volume maximal de solution titrante versé à l'équivalence.
On
suppose que tout le dioxyde de soufre s'est dissout dans l'eau et que
la réaction du dioxyde de soufre aqueux avec l'eau est très partielle, limitée.
2 MnO4-aq + 5 SO2 aq + 2H2O(l) ---> 5 SO42-aq + 2Mn2+aq + 4H+aq.
| Etat du système | avancement (mol) | 2 MnO4-aq | + 5 SO2 aq | | initial | 0 | C Véq | [SO2 aq] V | | en cours | x | C Véq-2x | [SO2 aq] V-5x | | fin | xf | C Véq-2xf =0 | [SO2 aq] V-5xf =0 |
C Véq-2xf =0 ; xf =½ C Véq ; [SO2 aq] V-5xf =0 ; [SO2 aq] = 5xf / V = 2,5C Véq / V ;
Véq = [SO2 aq] V / (2,5 C).
S(s) + O2(g) = SO2(g).
n(S) = n(SO2) =1/32,1 = 0,031 ~0,03 mol ; (nO2) = 1 / 24 =0,04 mol ( en excès).
[SO2 aq] = 0,031 / 0,200 =0,155 ~0,16 mol/L.
Véq = [SO2 aq] V / (2,5 C) = 0,155 *10 /(2,5*0,03) =20,6 ~21 mL.
Expérimentalement, on trouve Véq = 14 mL. Justifier.
Environ 30 % du dioxyde de soufre aqueux réagit avec l'eau selon :
SO2(aq) + 3H2O(l) ---> 2H3O+aq + SO32-aq.
SO32-aq ne réagit pas avec l'ion permanagnate, seul SO2(aq) est oxydé par l'ion MnO4-aq.
|
|
|