L'objectif
de cet exercice est de comprendre le maintien et la régulation du pH
des milieux biologiques, puis d'effectuer une étude de l'acide
lactique, acide intervenant dans les processus biologiques de notre
organisme.
On donne : CO2aq / HCO3-aq : CO2aq + H2O(l) = HCO3-aq + H3O+aq.
|
|
Les solutions tampons, maintien du pH des milieux biologiques.
Document 1 :
Dans les milieux
biologiques, les systèmes tampon amortissent les variations de pH lorsqu'il y a
une perturbation de l'équilibre acide-base. L'effet du système tampon est plus
efficace si la concentration en chacune des espèces le constituant est grande
et si le pKA du système tampon est proche du pH des milieux
biologiques ; l’effet est maximum lorsque pH = pKA. Dans le corps humain, le
pH du sang et des fluides extracellulaires varie peu autour de 7,4 et le pH
normal intracellulaire est de 6,8 à 7,0 selon les cellules.
Ainsi, le pH
intracellulaire est maintenu pratiquement constant grâce au système
"phosphate" (H2PO4-(aq) / HPO42–(aq)).
Donner une estimation de la valeur du pKa du couple (H2PO4-(aq) / HPO42–(aq)).
" le pH
normal intracellulaire est de 6,8 à 7,0 selon les cellules." : pKa (H2PO4-(aq) / HPO42–(aq)) ~ 6,9.
Document 2 :
Un autre système tampon
important dans l’organisme fait intervenir le couple dioxyde de carbone / ion hydrogénocarbonate
CO2(aq) / HCO3–(aq). Dans les conditions normales de respiration, la
concentration molaire en dioxyde de carbone dans le sang est telle que [CO2(aq)]
= α × p(CO2). α
est la constante de solubilité de valeur α = 0,030 mmol.L‑1.mmHg-1
et p(CO2) la pression
partielle du dioxyde de carbone dans l'alvéole pulmonaire exprimée en
millimètre de mercure (mm Hg). Sa valeur est normalement p(CO2) = 40 mmHg. La concentration molaire des ions
hydrogénocarbonate est [HCO3–(aq) ] = 24 mmol.L-1. l
Le pKa du couple CO2aq / HCO3-aq est égal à 6,1 à 37°C.
Montrer que le pH du sang humain est maintenu à la valeur habituelle dans les conditions normales de respiration.
pH = pKa ( CO2aq / HCO3-aq ) + log ([HCO3-aq] / [CO2aq ]).
[CO2aq ] = α × p(CO2) =0,030 10-3*40 =1,2 10-3 mol/L.
pH = 6,1 + log ([2,4 10-2] / 1,2 10-3) = 6,1 +1,3 = 7,4.
Document 3.
Les perturbations portant
sur la régulation du pH dans l’organisme peuvent provenir du métabolisme. Par
exemple les acidoses métaboliques peuvent être dues à une activité physique
importante au cours de laquelle un acide est fabriqué par l'organisme
suite à une mauvaise oxygénation des tissus.
Dans les acidoses
métaboliques, la réaction ventilatoire est rapide, elle implique une hyperventilation pour abaisser la quantité de dioxyde de carbone dans le sang, qui doit
normalement diminuer en quelques minutes.
Le sang contient, à l'état normal, 1,65 g.L-1 d’ions
hydrogénocarbonate et 0,060 g.L-1 de dioxyde de carbone dissous, les
concentrations en base et en acide pouvant être régulées par contrôle de leur
excrétion : CO2(g) par voie respiratoire (rapide) et HCO3– (aq) par voie rénale (lente).
A l'aide de l'expression de la constante d'acidité du couple CO2aq / HCO3-aq, expliquer comment une hyperventilation permet de corriger une acidose métabolique.
pH = pKa ( CO2aq / HCO3-aq ) + log ([HCO3-aq] / [CO2aq ]).
Lors d'une activité physique importante, l'acide lactique est fabriqué, ce qui abaisse le pH du sang. Une hyperventilation abaisse la quantité de dioxyde de carbone dans le sang, tandis que [HCO3-aq] et pKa restent constants : [HCO3-aq] / [CO2aq ] et en conséquence le pH du sang vont donc augmenter.
|
.
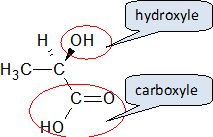
L'acide lactique.
L’acide produit par l’organisme lors d’une acidose
métabolique est l’acide lactique. C'est un acide faible de formule brute C3H6O3.
Recopier la représentation
de l’acide lactique figurant ci-dessous puis entourer et nommer les groupes
caractéristiques.
La figure ci-dessous représente deux simulations de courbes de titrage
pH-métrique de deux solutions aqueuses acides différentes par une solution
aqueuse d’hydroxyde de sodium (Na+(aq) + HO–(aq)).
Les deux acides sont l'acide chlorhydrique, un acide fort et
l'acide lactique, un acide faible. Les concentrations molaires en soluté apporté des deux solutions est c = 1,0 10-2 mol/L.
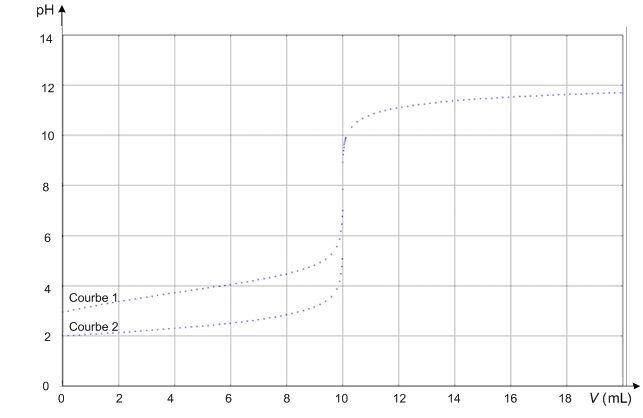
Calculer le pH de la
solution d'acide fort avant l’ajout de la solution aqueuse de soude et en
déduire la courbe correspondant à son titrage pH-métrique.
Pour un acide fort : pH = -log c = -log 0,010 = 2,0.
Courbe 2 : le pH initial est égal à 2, cette courbe correspond donc au dosage de l'acide chlorhydrique par la soude.
On donne
l'équation de la réaction de titrage de l’acide lactique :
CH3CHOHCOOH(aq) + HO–(aq) → CH3CHOHCOO– (aq) + H2O(l).
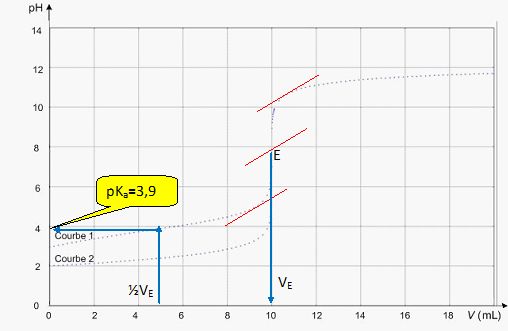
Montrer que pour un volume de solution
aqueuse de soude ajouté égal à ,
VE étant le volume versé à
l’équivalence, le pH de la solution vaut pKA.
En déduire une estimation du pKA
de l’acide lactique.
A la demi équivalence : [CH3CHOHCOOH(aq)]demi équivalence = ½[CH3CHOHCOOH(aq)]initial = ½.c VE.
[CH3CHOHCOO– (aq)]demi équivalence =½.c VE.
Or pHdemi équivalence = pKa + log ([CH3CHOHCOO– (aq)]demi équivalence /[CH3CHOHCOOH(aq)]demi équivalence ) = pKa.
Précision d'un titrage :
Un élève effectue le titrage colorimétrique d'un
volume VA = (20,0 ± 0,05) mL d'une solution aqueuse
d'acide lactique de concentration molaire attendue cA = (2,22 ± 0,005) × 10 – 2 mol.L– 1 par une
solution de aqueuse de soude étiquetée «concentration cB = (3,00
± 0,01) × 10 – 2 mol.L– 1».
La valeur du volume à
l’équivalence relevée par un élève est VE = (10,1 ± 0,3) mL.
L’estimation de l’incertitude sur la mesure est liée au repérage de
l’équivalence et à la précision de la burette dans les conditions de
l’expérience.
Déterminer la concentration molaire expérimentale cAexp en acide lactique,
obtenue par l’élève.
A l'équivalence : VA cA exp = cB VE ; cA exp = cB VE / VA=3,00 10-2 * 10,1 / 20,0 =1,515 10-2 ~1,52 10-2 mol/L.
On définit l’incertitude
relative d’une grandeur X par le
rapport DX / X .
On estime qu’une incertitude relative est négligeable devant une autre, si elle
est environ dix fois plus petite.
Montrer que les
incertitudes relatives sur VA
et cB sont négligeables devant celle sur VE.
DVA / VA = 0,05 / 20,0 =2,5 10-3 ; DcB / cB = 0,01 / 3,00 =3,3 10-3 ; DVE / VE = 0,3 / 10,1 =3,0 10-2.
DVE / VE > 10 DVA / VA =DVE / VE > 10 DcB / cB.
Dans cette hypothèse, on
peut montrer que l’incertitude relative DcA exp / cA exp est égale à DVE / VE .
En déduire l’encadrement de la concentration molaire en acide lactique cAexp, obtenue par l’élève.
DcA exp / cA exp = 3,0 10-2 ; DcA exp =3,0 10-2 cA exp = 3,0 10-2 *1,515 10-2 ~ 5 10-4 mol/L.
cA exp = (1,52 ± 0,05) × 10 – 2 mol.L– 1.
L’encadrement de la
concentration molaire obtenue expérimentalement est-elle cohérente
avec l’encadrement de la concentration molaire attendue ? Justifier.
Quelle(s) raison(s)
pourrai(en)t expliquer un écart éventuel entre l’encadrement attendu et
l’encadrement expérimental ?
|cA exp -cA | /cA = (2,22 -1,52) / 2,22 =0,32 ( 32 %). Cet écart est très important.
Mauvaise manipulation de l'élève lors de la détermination de VE ou de la prise de l'acide lactique.
La concentration de la soude est fausse.
|
|
|


